서 론
직장 신경내분비종양(neuroendocrine tumor)은 직장에서 발생하는 종양 중 비교적 드문 질환이나, 최근 유병률이 점차 증가하고 있다. 대장내시경의 발달과 선별 검진의 광범위한 보급에 의한 것으로 생각되지만, 우리나라에서는 생활습관이나 식이 습관의 서구화도 영향을 미칠 것으로 생각된다. 직장에 발생하는 신경내분비종양은 이전에는 칼시노이드(carcinoid)로 불리던 종양으로 이 질환에 대한 병태 생리학적 이해가 늘어감에 따라 명칭에 의한 혼선을 없애고자 그 이름이 변경된 종양이다. 위장관 어디에도 발생할 수 있고, 대장과 직장에서는 특히 직장이 차지하는 비율이 절반 이상으로 보고될 정도로 높다. 대게 내시경을 통해 초기에 발견되는 경우가 많아서, 유병률의 빠른 증가에도 불구하고 분화도가 좋은 경우가 많으며, 이와 동반하여 진단 이후에도 적절한 치료가 된다면 장기 생존율이 높은 것으로 알려져 있다[1–7].
직장 신경내분비종양의 치료의 원칙은 종양의 완전 절제이다. 직장 신경내분비종양은 무증상으로 내시경에서 발견되는 경우가 많아 발견 당시에 상대적으로 작은 크기를 가지고 있고, 절제 후 예후가 좋은 것으로 알려져 있다. 많은 연구에서 1 cm 이하의 점막하층까지 침범된 직장 신경내분비종양은 국소 절제만으로 충분하다는 결과를 보고해 왔다. 2 cm 이상의 종양에 대해서는 광범위 직장 절제 및 림프절 절제술이 필요할 수 있다고 생각되지만, 광범위 절제의 적응이 되는 기준에 대해서는 논란이 많고, 여러 다른 위험인자들이 제시되기도 한다. 1–2 cm의 종양에 대해서는 아직까지 정립된 치료방법이 없는 실정이지만, 직장 신경내분비종양의 치료에 있어서는 직장의 기능적인 중요성과 함께 조기 진단이 비교적 쉽기 때문에 다른 위험인자가 없는 경우 국소 절제를 고려해 볼 수 있다. 종양의 제거를 위한 수술적 치료는 경항문 절제술을 통해 비교적 어렵지 않게 시행할 수 있지만, 내시경적으로도 절제할 수 있다. 최근에는 내시경 장비의 비약적 발달을 통해 내시경적 치료의 영역 또한 점차 발전하고 있어 내시경적 절제가 점점 증가하고 있다[6–9].
그러나, 아직까지 직장 신경내분비종양의 국소 절제의 방법에 대한 차이나 적용 기준에 대한 연구는 거의 없는 실정이고, 국소 절제 후 광범위 절제의 적응증 역시 확실하게 정립되어 있지는 않다. 따라서, 본 연구는 직장 신경내분비종양의 국소절제술을 시행한 환자들을 통하여 국소절제술 이후의 장기간 관찰 결과를 확인하고자 하였으며, 수술을 통한 경항문 절제술과 내시경적 국소절제술의 차이를 확인해 보고자 하였다.
방 법
2000년 1월부터 2015년 7월까지 서울대학교 병원에서 대장과 직장 종양으로 수술을 시행 받은 환자들을 전향적으로 등록한 데이터베이스에서 직장 신경내분비종양으로 진단 받고 경항문 절제술(transanal excision, TAE) 혹은 내시경 점막 절제술(endoscopic mucosa resection, EMR)이나 내시경 점막하 박리술(endoscopic submucosal dissection, ESD)을 시행 받은 환자들의 의무 기록을 후향적으로 분석하였다. 국소절제술 후 직장 및 림프절 광범위 절제를 시행한 환자는 분석 대상에서 제외하였다.
환자들의 임상적 특성, 수술 및 진단에 대한 자료는 서울대학교 병원 전자 의무기록을 토대로 하였으며, 경과 관찰 기간은 경항문 절제술 혹은 내시경적 절제술을 시행한 날로부터 최근 외래 방문 일까지로 하였다. 임상적 정보로 환자의 성별, 나이, 기저 질환, 병변의 위치, 항문연으로부터의 거리(anal verge, AV), 수술 소견 및 내시경 소견을 확인하였다. 모든 환자에서 내시경을 시행하였고, AV 측정은 내시경 소견으로 측정되었다. 병변의 크기는 병리 최종 보고를 따랐으며 수술 시행 이전에 조직검사 등으로 크기가 감소하거나 남은 병변이 없는 경우에는 두 가지 병리 보고에 기록된 크기를 합산하여 측정하였다. 병변의 특성을 확인하고자 병리학적 소견도 수집하였으며 이에는 병변의 크기(size), T 병기, 종양 등급(grade), 유사분열지수(mitosis count), 혈관, 림프관 혹은 신경 침범 소견(vascular invasion, lymphatic invasion, perineural invasion), 절제연의 종양 침범(resection margin) 등을 확인하였으며 면역화학염색 소견(Ki-67 index)을 추가로 확인하였다. 추후 경과 관찰 기간에는 직장 수지 검사, 대장 혹은 에스결장 내시경, 전산화단층촬영(computed tomography, CT), 자기공명영상(magnetic resonance imaging, MRI), 혹은 양전자단층촬영(positron emission tomography, PET)이 포함되어 있었으며 필요에 따라서는 조직검사가 시행되기도 하였으며 재발 유무를 중점적으로 확인하였다.
통계 분석은 SPSS ver. 22.0 Windows (SPSS Inc., Chicago, IL, USA)를 사용하였다. 두 군의 차이에 대한 통계학적 검증을 위하여 Student T-test와 Pearson's Chi-square test, Fisher's exact test를 이용하였고, 재발 및 무병생존율은 Kaplan-Meyer method를 이용하여 분석하였다. P<0.05일 때 통계적으로 유의하다고 판정하였다.
결 과
총 40명의 환자가 직장 신경내분비종양으로 국소 절제를 시행 받았으며, 경항문 절제술이 28건(70%), 내시경적 절제술이 12건(30%)으로 확인되었다. 내시경적 절제술은 점막하 박리술이 7건(17.5%), 점막절제술이 5건(12.5%)이었다. 종양의 항문연으로부터의 거리가 통계적으로 유의하지는 않았지만, 내시경적 절제술에서 약간 먼 경향을 보였다(5.04±1.73 cm vs. 6.42±1.98 cm, P=0.049). 종양의 크기는 경항문 절제술에서 약간 큰 것으로 분석되었으나, 역시 통계적으로 유의하지 않았다(0.70±0.34 cm vs. 0.52±0.30 cm, P=0.082). 환자들의 임상적 특성을 Table 1에 정리하였다.
Table 1.
Clinical characteristics of patients with rectal NET
국소절제술 후 병리 기록을 분석해 보았을 때, 모든 환자에서 T 병기가 1기였고, 대부분의 환자에서 종양 등급이 1등급이었다. 혈관이나 림프관 침범 소견은 없었고, 신경 침범이 국소절제술에서 1명(3.6%)이 있었다. 절제연의 종양 침범에서 내시경적 절제술을 시행 받은 환자에서 양성 소견이 좀 더 많은 것으로 보였지만, 통계적으로 유의하지는 않았다(7.1% vs. 25%, P=0.246). 국소절제술 후 병리학적 소견을 Table 2에 정리하였다.
Table 2.
Pathologic characteristics after local excision of rectal NET patients
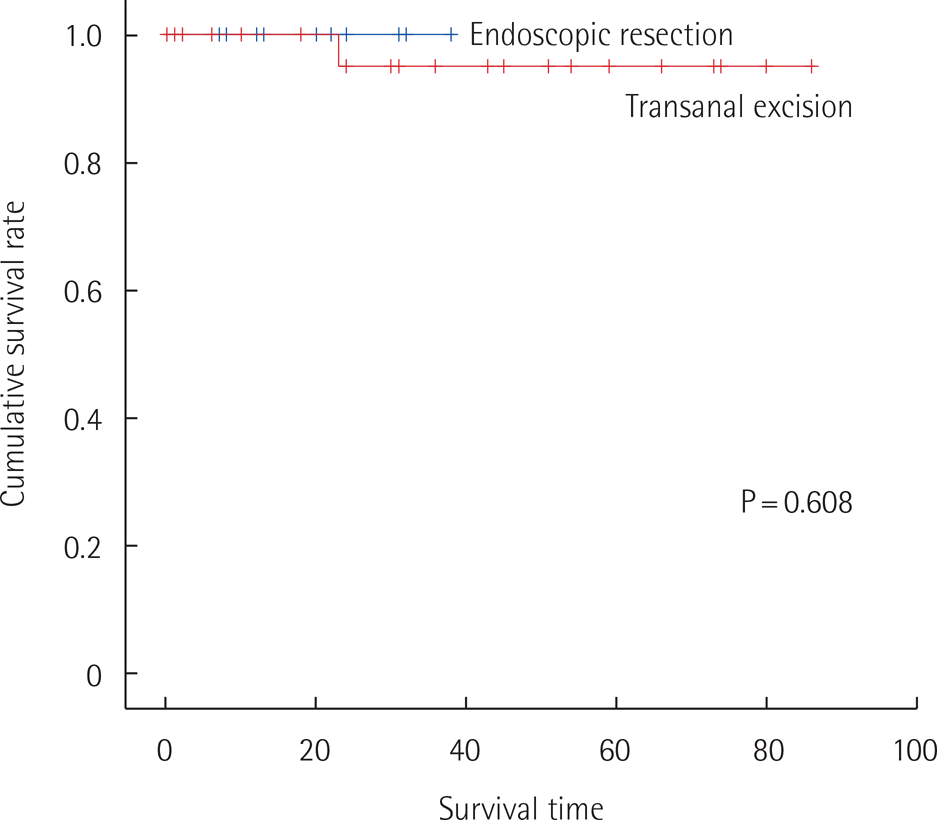
모든 환자의 추적관찰 기간의 중간 값은 24개월(범위, 0–86개월)이었으며, 경항문 절제술이 30개월(범위, 0–86개월), 내시경적 절제술이 22개월(범위, 7–38개월)이었다. 총 1명(2.5%)의 환자에서 재발하였고, 경항문 절제술을 시행받고 8개월 후에 재발하였으며, 직장 수지 검진상 수술 부위에 만져지는 덩어리로 발견하였다. 초기 경항문 절제술 당시, 종양의 크기가 1.6 cm였으나, 종양 등급이 1등급이고, 혈관, 림프관, 신경침범소견이 없으며, 절제연의 결과가 음성이었다. 추적관찰 중 시행한 CT상 림프절 전이 소견이 없어 다시 한번 경항문 절제술이 시행되었고, 그 이후에는 15개월의 기간 동안 재발 소견 없이 외래를 통한 추적 관찰하였다. 재발 및 무병 생존율에 대한 분석을 Fig. 1에 나타내었다.
고 찰
직장 신경내분비종양은 내시경을 통한 조기 발견이 증가하고 있고, 국소 절제가 용이하여 적절한 치료가 이루어진다면 좋은 예후를 보일 수 있다. 본 연구에서는 국소 절제를 통한 치료를 시행한 환자들의 추적 관찰 결과를 확인하여 국소 치료의 유용성과 함께 수술을 통한 경항문 절제와 내시경적 절제술의 차이를 확인해 보고자 하였다. 국소절제술을 시행한 모든 환자에서 추적관찰 기간 동안 사망 환자는 한 명도 없었으며, 재발은 경항문 절제술을 시행한 한 명의 환자에서 발생하였으나, 다시 한번 국소절제술이 가능하였다.
직장 신경내분비종양의 국소절제술을 고려 할 수 있는 가장 중요한 인자로는 종양의 크기로 종양의 직장 벽 침습과 림프절 전이의 정도와 연관성이 있다는 보고들이 오랜 기간 동안 강조되어 왔다. 많은 연구에서 1 cm 이하의 작은 크기의 종양은 림프절 전이가 드물어서 국소 절제도 안전하다고 보고하고 있다[10,11]. 현재는 종양의 병리학적 특성이 예후를 예측하는 중요 인자들로 많이 주목 받고 있으나 조직검사를 통해서만 확인이 가능하다는 단점이 있다. 그런 면에서 조직 검사 혹은 수술적 검사를 시행 하기 이전에 예후를 예측하고 수술적 치료 유무를 결정하는데 종양의 크기는 여전히 매우 중요 인자이다. 대체로 종양의 크기가 2 cm가 넘어가는 경우에는 수술적 치료를 시행하도록 권고하고 있으며, 1 cm 이하는 림프절 전이가 낮으며 위험도가 3%보다 낮은 것으로 보고 되고 있다[7,9,12,13]. 하지만 최근에는 종양의 크기가 1 cm 미만에서도 림프절 전이에 대한 보고도 있으며 원격 전이도 보고 되고 있어 작은 크기에서도 다른 위험 인자를 고려해야 하며 림프절 절제를 포함한 수술적 치료가 필요하다는 주장도 제기되고 있다. 다른 위험인자로는 침범 깊이가 깊어 지는 경우, 혈관이나 림프관의 침습이 있는 경우 등이 보고되고 있다[14–16]. 본 연구에서 평균 종양 크기는 0.63±0.37 cm으로 범위는 0.1 cm에서 1.6 cm까지 분포되어 있었다. 실질적으로 1 cm을 넘는 경우는 6명으로 1.1 cm에서 1.3 cm이 대부분이며 1명만 1.6 cm으로 확인되었다. 현재 1명을 제외한 환자에서 종양의 재발 증거 없이 추적관찰 중으로, 크기가 작은 직장 신경내분비종양은 국소절제술 만으로도 충분히 안전하고 효과적으로 치료할 수 있다는 것을 보여주는 결과라고 할 수 있겠다.
직장 신경내분비종양의 치료에서 광범위 절제가 필요한 림프절 전이에 관련된 위험 인자로 알려진 것들 중에서는 혈관이나 림프관 침범이 가장 중요한 인자로 알려져 있다[15,17–20]. 이러한, 혈관이나 림프관의 침범은 대장암의 선암종(adenocarcinoma)에서도 림프절 전이의 위험인자로 알려져 있다. 따라서 조기 대장암의 경우에도 국소절제술 후 이러한 혈관이나 림프관의 침범이 있는 경우, 광범위 절제를 시행하는 것을 권장하고 있다[21]. 본 연구에서는 국소절제술 후 혈관이나 림프관의 침범을 보이는 환자는 없었고, 영상 의학적 검사상에 림프절 전이 소견을 보이는 환자는 없었으며, 이러한 환자의 특성 또한 생존율에 좋은 영향을 미쳤을 것으로 생각된다.
신경내분비종양과 관련된 여러 가지 면역화학염색에 대한 연구가 다양하게 진행되었고 최근에는 그 중에서 Ki-67에 대한 것이 중요하게 대두 되었다. Ki-67은 예후를 예측할 수 있는 단독 인자로도 많이 알려지게 되었으며 현재는 2010 WHO 분류와 European Neuroendocrine Tumor Society (ENETS) 가이드 라인에서 등급 분류에 Ki-67 index를 사용하고 있다[22,23]. 이러한 Ki-67 index는 유사분열지수보다 종양의 분화도를 더욱 정확하게 반영할 수 있는 것으로도 알려져 있다[24]. WHO의 등급 분류에 따르면 유사분열지수와 Ki-67 index를 통해 등급을 결정하게 되는데, 유사분열지수가 2 미만 이거나 Ki-67 index가 2 이하인 경우에 등급 1 (grade 1), 유사분열지수가 2 이상이면서 20 이하 이거나 Ki-67 index가 2 초과이면서 20 이하인 경우 등급 2 (grade 2), 그리고 유사분열지수가 20 초과 이거나 Ki-67 index가 20 초과인 경우에 등급 3 (grade 3)로 결정하게 되며 ENET 분류도 이와 같다[23]. 이후의 많은 연구들에서도 이러한 WHO의 등급 분류가 예후를 예측하는데 적절한 역할을 하고 있다는 것을 발표하였다[24–26]. 본 연구에서는 유사분열지수와 Ki-67 index로 분류한 등급에서 2등급의 환자가 4명(10%)있었고, 이 환자들 모두에서 재발은 없었다. 따라서 이러한 WHO 등급 분류가 국소절제술 이후 림프절을 포함한 광범위 절제술이 필요한 적응 기준이 될지에 대한 좀 더 많은 연구가 필요하다고 하겠다.
직장의 신경내분비종양은 조기에 진단이 가능할 뿐 아니라, 항문을 통한 접근이 용이하여 국소적인 절제가 가능하다는 위치적 장점을 가지고 있다. 국소절제술의 가장 기본이 되는 수술적 치료법은 경항문 절제술로 육안적으로 종양을 보면서 수술을 할 수 있어 종양의 완전 절제 및 절제연의 안전한 확보에 있어 장점을 가지고 있다고 할 수 있다. 최근에는 복강경과의 접목을 통한 경항문 내시경 미세수술(transanal endoscopic microsurgery)까지도 치료에 적극 이용되고 있으며, 절제연의 확보에 있어 경항문 절제술보다 효과적이라는 몇몇 연구가 있으나 그 안정성에 대한 연구는 지속적으로 진행되고 있다[27]. 그러나, 종양이 항문연으로부터의 거리가 멀다면, 육안적으로 확인 할 수 있는 범위가 줄어들게 되어 수술적 치료가 안전하지 못할 가능성이 있어 내시경적 치료가 대안이 될 수 있고, 최근의 많은 연구에서 내시경적 접근을 통한 점막 절제술이나 점막하 박리술로 안전하게 종양을 제거할 수 있으며, 종양의 예후도 좋은 결과를 보고하고 있다[13]. 본 연구에서도 내시경적 국소절제술에서 항문연으로부터의 거리가 조금 더 먼 경향이 있는 것으로 분석되었고, 재발은 없었다. 절제연의 종양 침범이 조금 더 많았으나, 통계적으로 의미가 없었다. 절제연의 종양 침범에 따른 추가적인 광범위 절제의 결정에 있어서는 신중해야 하며, 내시경 절제 후 조직의 회수 과정에서 발생할 수 있는 절제연의 손상을 고려해야 하고, 따라서 시술을 시행한 내시경 의사의 육안 검사상 완전 절제가 이루어 졌는지 판단이 중요하다고 하겠다. 내시경적 국소절제술 중에 점막하 박리술은 점막 절제술 보다 절제연을 좀 더 안전하게 확보하면서 시술하기 때문에, 종양의 치료 측면에서 더 효과적인 장점이 있다고 생각되지만, 시술이 어렵고 천공 등의 합병증의 가능성이 보다 높은 것으로 되어 있어 고도의 숙련된 내시경 의사만이 시행할 수 있다는 단점이 있다. 이러한 내시경적 국소절제술의 안전성 및 효과에 대한 논란이 여전히 있지만, 마취나 수술 없이 치료할 수 있다는 점에서 경항문 국소절제술보다 최근에 좀 더 증가하고 있는 경향이 있는 것은 사실이다[11,28].
내시경 절제연 양성으로 확인되었을 때에는 재발의 위험성을 고려하여 추가적인 절제(경항문 절제 혹은 내시경적 절제)를 시행하여 절제연 음성을 확보하는 것이 일반적인 치료이다. 본 연구에서는 절제연의 종양 잔존 여부를 판단하기 힘든 경우에도 양성으로 분류하였으며 이 경우 환자와의 상의를 통해 주의 깊게 추적 관찰을 시행하였다. 이는 내시경 절제 시 전기 소작 사용으로 절제된 부위 주변으로 약 1–2 mm 정도의 괴사 영역이 있는 것으로 판단되기 때문에 내시경 절제 시 육안적으로 완전 절제가 되었다고 판단되면 추적관찰 할 수 있다고 생각되기 때문이다[29].
본 연구는 후향적 코호트 연구로서 몇 가지 제한 점을 가지고 있으며, 단일 병원에서 진행된 연구로 환자수가 상대적으로 많지 않아 통계적인 결론을 도출하기 어려운 점이 있을 수 있다. 직장에서 발생하는 신경내분비 종양의 치료에서 국소절제술을 시행한 환자만을 선택했으며, 전향적 무작위 배정 임상시험으로 경항문 절제술과 내시경적 절제술을 비교한 연구가 아니기 때문에, 두 군에서 선택비뚤림(selection bias)이 발생할 수 있고, 수술자나 환자의 치료 방침에 따라 예후가 결정될 수 있다. 또한, 국소절제술을 결정하는데 있어 림프절 전이 여부에 대한 평가를 CT나 MRI, PET 등의 검사를 통해서 시행하였는데, 이러한 영상의학적 검사에 대한 민감도, 특이도 역시 많은 연구가 되어 있지는 않은 실정이다. 다만, 본 연구에서 원격 전이나 사망에 이르는 질병의 진행이 일정기간의 추적관찰 기간 동안 확인되지 않았기 때문에, 현재까지 림프절 전이는 없는 것으로 판단되며, 향후에도 지속적인 추적관찰이 이루어질 계획이다.
직장 신경내분비종양에서 국소절제술 이후의 추적 관찰 결과, 낮은 재발률과 높은 생존율을 보였다. 이는 본 연구에서 국소절제술을 시행한 환자들의 종양의 크기가 작고, 분화도 및 등급이 낮으며, 혈관이나 림프관의 침범이 없었기 때문으로 생각된다. 본 연구에서 재발이 발생한 환자는 종양의 크기가 1.6 cm인 경우이며, 나머지 환자는 모두 1.3 cm 이하로 현재 재발 없이 추적관찰 중이며, 이러한 환자들에서는 국소절제술이 안전하게 시행될 수 있다고 판단된다. 경항문 절제술과 내시경적 절제술의 차이는 없었고, 두 방법이 모두 안전하고 효과적인 방법으로 생각된다. 따라서, 직장 신경내분비종양의 치료에 있어 국소절제술의 적응이 되는 환자를 잘 선택한다면, 좋은 결과를 얻을 수 있으며, 위험인자를 가지고 있는 환자들에서는 재발 및 전이가 발생하지 않는지 경과 관찰 기간 동안에 주의 있게 확인하는 것이 필요하다고 하겠다.