서 론
대장암은 서구사회에서 높은 발생률을 보이는 고형 암으로 최근에는 국내에서도 대장암의 발생률이 증가하는 추세이다. 2013년도 보건복지부 조사결과에 따르면 국내 전체 암 발생 중 대장암의 발생률은 12.3%에 해당하며, 갑상선 암, 위암에 이어서 세 번째로 많이 발생하며[1], 폐암, 간암, 위암에 이어 네 번째로 사망률이 높다. 전이가 없는 대장암 환자의 경우는 수술만이 완치를 기대할 수 있는 치료법이고, 고위험군 2기 또는 3기의 환자에서 재발의 위험을 줄이기 위해 보조항암화학치료가 수술과 더불어 기본적인 치료로 시행되고 있다[2]. 하지만, 대장암 환자에서 적극적인 수술적 절제 및 추가적인 치료가 시행됨에도 불구하고, 림프절 혹은 원격전이가 있는 대장암의 경우 5년 생존율이 25%–60%로 여전히 낮은 상태이다[3]. 최근에는 수술 이외의 항암치료로서 여러가지 표적치료제가 개발되어 대장암 환자의 치료에 사용되고 있다. 대표적으로 epidermal growth factor receptor (EGFR)의 항체를 이용한 표적치료제가 대장암의 치료에 사용되어 기존의 치료에 추가하여 사용하였을 때 생존율의 증가를 보이기도 하였다[4]. 그 외에도 vascular endothelial growth factor (VEGF)를 억제하는 항체 및 대장암의 발현에 관여하는 여러 물질과 관련된 tyrosine kinase 억제제 등이 계속 개발되고 있고 일부는 효과를 보이고 있다. 이러한 표적치료 외에도 종양 주변의 미세환경이나 면역기능에 따라 종양 성장 조절 및 세포사가 유도되는 것이 확인되었다. 면역과정과 관련하여, T세포의 활성에 관여하는 인자인 programmed death 1 (PD-1)의 발현 정도는 종양의 활성도, 예후 와의 관계를 보이는 것으로 알려져 있다[5,6]. 이와 같이 면역기능이 종양의 성장, 억제에 관여하는 것이 밝혀지면서 이에 대한 관심이 높아지고 있다.
Defensin은 29–42개의 아미노산으로 구성되는 양이온 peptide로 분자 내 이황화물 결합을 형성하는 6개의 cysteine 구조로 되어있다. Phagocytes, paneth 세포, 기타 상피세포 등 여러 가지 세포에서 유래하며[7], 광범위한 항균성과 다양한 발현성을 가지고 선천적 항균면역 작용을 하는 것으로 알려져 있다[8–10]. 인간에 있어서 defensin은 이 6개의 cysteine 잔기들의 배치와 연결성에 따라 alpha-defensin (1↔6; 2↔4; 3↔5)과 beta-defensin (1↔5; 2↔4; 3↔6) 두 종류로 분류할 수 있다. 이 중 한 아형인 defensin alpha 6 (DEFA6)는 점막 조직의 보호를 포함한 선천성 면역에 크게 기여하는 항균 peptide이며, 소장의 Paneth 세포의 리소자임이 풍부한 과립에서 주로 발견된다[11]. 소화관의 숙주 방어에 관여함에 따라, 주로 만성적으로 염증이 있는 결장에서 증가하며, 상대적으로 정상 조직에서는 수가 적은 것으로 보고되고 있다[12]. 또한 여러 연구에서 이미 alpha defensin이 여러 종류의 종양에서 증가하는 것이 보고 되었으며, 이는 alpha defensin 이 종양의 형성과 공격성과의 관련성이 있음을 시사하고 있다[13–15].
본 연구의 목적은 이와 같은 사실을 바탕으로 대장암에서 DEFA6의 원발암 유전자로서의 가능성과 대장암 환자에서 DEFA6 발현의 임상적 의의를 알아보고자 하였다.
방 법
순천향대학교 천안병원에서 2009년 1월부터 2010년 12월까지 대장암으로 수술을 시행한 151명 환자들을 대상으로 하였다. 종양의 병기는 American Joint Committee on Cancer 7판을 기준으로 분류하였다. 외과적으로 절제된 대장암조직의 대표적인 종양 부위에서 파라핀 포매(embedding)에 의해 조직 미세배열(tissue microarray, TMA) 블록 절편을 만들어 면역조직화학 염색을 시행하였다.
1차 DEFA6항체(Novus Biologicals, Littleton, CO, USA)를 1:100으로 희석하여 4°C에서 24시간 반응 후, 2차항체인 anti-rabbit HRP-La-belled Polymer (EnVision, Dako, Santa Clara, CA, USA)를 사용하여 실온에서 2시간 동안 처리하였다. 발색을 위해 Diaminobenzidine (DAB, Dako)으로 상온에서 10분간 처리하였다. 각각의 판독은 2명의 병리학자에 의해서 시행되었다. 통계검증은 SPSS ver. 14.0K (SPSS Inc., Chicago, IL, USA)를 이용하여 DEFA6 음성군과 양성군의 임상병리학적 변수들을 Pearson chi-square test를 이용하여 비교하였다. 대상 환자의 추적은 후향적으로 의무기록과 전화추적을 통해 시행하였으며 음성군과 양성군과의 5년 생존율을 Kaplan-Meier법을 이용하여 비교하였다. 모든 결과는 P<0.05일 때 통계학적으로 유의한 것으로 정의하였다. 본 연구는 순천향대학교 임상윤리심의위원회의 승인을 받아 시행하였다.
결 과
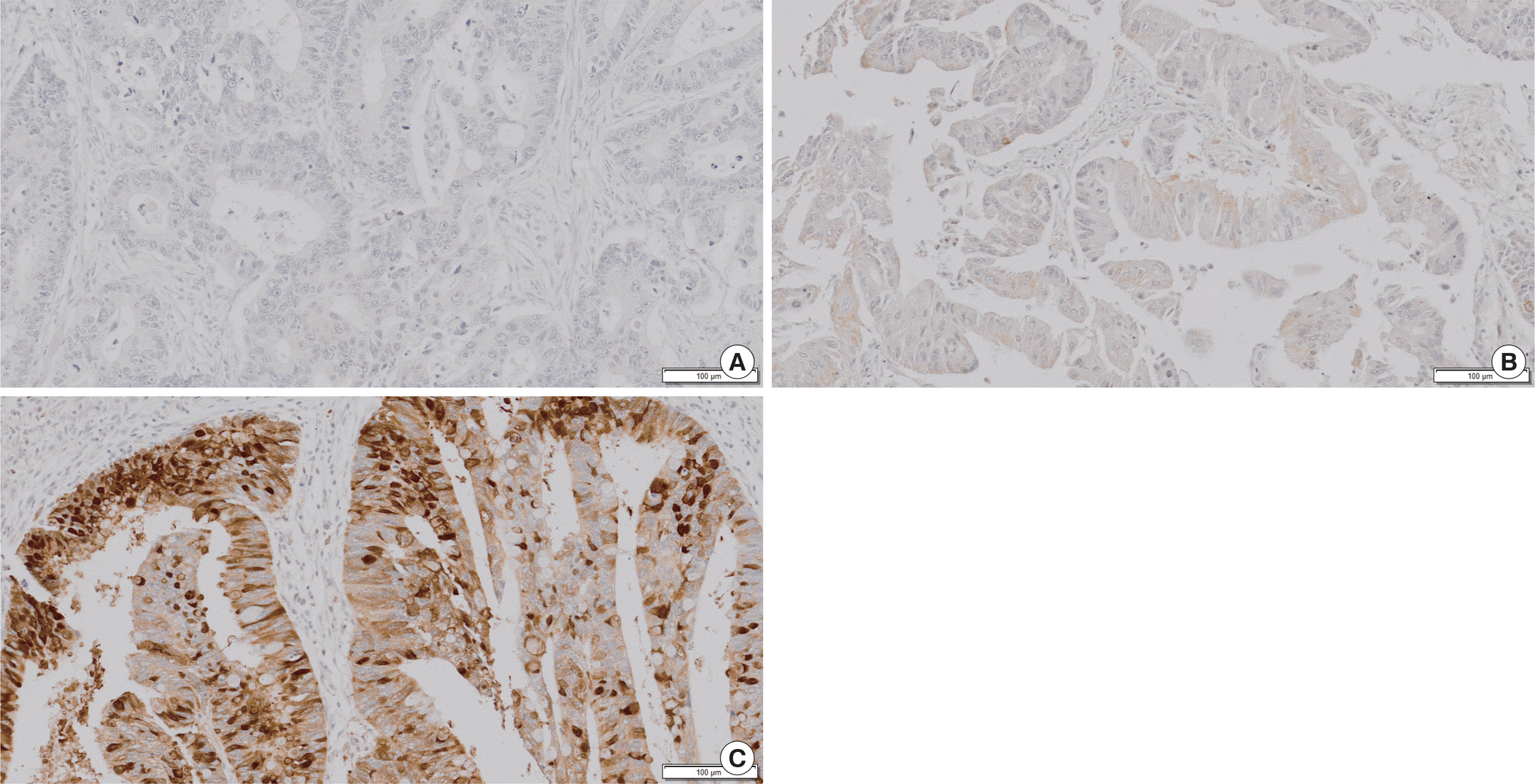
151예 대장암 환자에서 면역조직화학 염색을 시행하였으며 DEFA6의 발현은 2명의 병리학자가 따로 판독하였다. 대장암 조직에서 종양의 염색 정도에 따라 음성(–), 약 양성(weak positive, +), 중등도 양성(Moderate positive, ++) 강양성(strong positive, +++)으로 분류하여 판독하였다(Fig. 1). 발현 여부에 따라서 염색이 되는 종양은 양성으로 분류하였고, 그 외에는 음성으로 분류하였다. 38 (25.2%)예에서 DEFA6가 발현되었고, 113 (74.8%)예에서는 발현되지 않았다(Table 1). 전체 대상 환자 151예 환자의 평균 연령은 63.6세(범위, 33–87세, 중위값 66)였으며, 60세를 기준으로 발현 정도를 분석하였을 때, 두 군간의 차이는 없었다. 남녀 성비에 따른 발현 정도는 두 군에서 차이를 보이지 않았다. T 병기와 N병기에서 병기가 높을수록 DEFA6의 발현이 나타나는 경향을 보였다(P=0.002, 0.023) 또한, 림프절 전이와 미세혈관 침습이 있을수록 DEFA6의 발현이 나타나는 경향을 보였다(P=0.020, 0.049). 그러나, TNM 병기, 림프관 침입과는 관련성이 없었다(Table 2). 그 외에도 신경침습이나 원격전이와 관련성은 없었다.
Table 1.
Expression of DEFA6 in colorectal cancer tissue as determined by immunohistochemistry
| Expression |
DEFA6 |
|||
|---|---|---|---|---|
| − | + | ++ | +++ | |
| No. (%) (total = 151) | 113 (74.8) | 21 (13.9) | 9 (6.0) | 8 (5.3) |
Table 2.
Relationships between expression of DEFA6 and clinicopathological factors
Fig. 1.
Immunohistochemistry stain of tumors with increased DEFA6 (immunohistochemical stain, ×200). (A) Negative stain in colorectal carcinoma. (B) Weak positive staining in colorectal carcinoma. (C) Strong positive staining in colorectal carcinoma. DEFA6, defensin alpha 6.
DEFA6의 음성군과 양성군 간의 생존율을 Kaplan-Meier 법을 이용하여 비교하였다. 사망 및 생존이 확인된 환자를 대상(범위, 0–86개월, 중위값 46개월)으로 60개월간의 생존율을 분석하였다. 전체적으로 DEFA6 양성군에서 조기에 사망하는 경향을 보였으나 양성군과 음성군과의 생존율은 통계적으로 의미는 없었다(Fig. 2) (P=0.228).
고 찰
대장암은 전세계적으로 암환자 사망의 주요 원인이며 이를 치료하기 위해 여러 연구가 행해지고 있다. 대부분의 경우 대장암은 비교적 천천히 진행된다. 대장암은 대부분 작은 양성 용종에서 점차 큰 이형성 병변으로 진행되어 결국 악성으로 발전되는데,이러한 점진적 진행은 결국 대장암을 예방하고 치료할 수 있는 충분한 기회를 제공한다[16]. 대장암은 적절한 수술적 절제 및 항암화학치료 등의 보조요법을 시행함에도 불구하고 근치적 절제를 시행 받은 환자의 30%–50%에서 2년 내에 재발한다[17,18]. 결국 다양한 치료법에도 불구하고 이와 같은 치료에 반응이 적거나 없는 경우가 존재하기 때문에, 종양의 성장 및 재발에 있어서 현재로서는 완벽하게 설명되지 않는 다양한 기전이 작용할 것이라 생각된다. 대장암의 재발과 대장암 환자의 사망에 영향을 미치는 대표적 요인으로는 전이가 중요한데, 악성 암 세포가 원발 부위를 떠나서 림프절 혹은 타 장기 전이를 위해서는 종양이 이주성(migration)과 침습성을 가져야 한다. 이 기전에 대한 연구가 현재까지 다양하게 진행되고 있으나 아직까지 명확한 기전은 밝혀지지 않고 있다.
최근 대장암에서 기존의 고식적인 세포 독성 치료 외에 다양한 표적치료가 중요한 항암 치료 방법으로 사용되고 있다. 표적치료는 악성세포의 성장 혹은 전이 과정을 억제함으로 생존율의 증가를 보였다. 대표적인 표적치료제의 하나인 항 EGFR 제제는 유전적 변이에 따른 다양한 반응성의 차이를 나타내기 때문에 보다 효과적인 적응증을 위해 추가적인 다양한 연구가 진행되고 있다. 또한 최근에는 항 PD-1과 같은 면역관련 항암제의 효용성, 발현 정도와 예후와의 관계에 대한 다양한 연구가 보고되고 있다[5,6]. 이러한 연구의 결과를 고찰해 보면 악성종양과 면역기능과의 사이에는 밀접한 관련성이 있을 것으로 생각되고 있다.
Alpha defensin은 인간 호중구에서 총 단백질의 5%–7%를 구성한다고 알려져 있다. Alpha defensin은 선천적 면역, 상처 치유, 종양의 성장과 침습 등, 다양한 생물학적 기능을 갖는다. 주로, alpha defensin 은 호중구에 존재한다고 알려져 있지만, 최근의 연구에 따르면 장내 Paneth 세포에서도 발견되며, 림프구와 단핵구 그리고 관상동맥의 평활근 세포의 일부분을 구성하기도 한다[19,20]. Paneth 세포는 Li-eberkühn 선(crypts of Lieberkühn)의 바닥에 위치한 소장의 분비세포로, 이 세포의 여러 유전적 결함은 회장 크론병의 발병에 중요한 역할을 한다[21]. Paneth 세포의 중요한 기능은 항균 peptide의 분비이며, 주로 alpha defensin-5와 alpha defensin-6이다[22–23]. 또한, alpha defensin-5와 alpha defensin-6의 발현이 감소된 경우, 회장 크론병과도 관련이 있었고, 이식편대숙주 질환에서도 많이 나타나는 것이 확인되었다[24,25]. 방광암 환자에서도 소변 내 alpha defensin의 증가가 발견되었는데, 이와 같은 연구의 결과로 alpha defensin은 인체의 면역체계에서 어떤 역할을 할 것이라고 생각되었으며, 증가된 alpha defensin은 방광암 환자의 소변에 포함된 alpha defensin이 종양 내 침투한 호중구나 다른 면역세포에서 유래한 것이라고 예상하였다.
Alpha defensin은 양 친매성을 이용하여 병원체에 부착하여 막 구조의 파열을 유발시킴으로써 병원체를 파괴하는 능력을 가지고 있다. 또한, alpha defensin은 세포막의 이온 균형을 깨뜨리고 미생물의 표면에 구멍을 내어 결국 세포사를 유도한다. 이로 인해 그람 양성균, 그람 음성균, 곰팡이, 기생충 그리고 human immunodeficiency virus을 포함한 외막형 바이러스 등에 대한 면역작용을 한다[26,27]. Chu 등[28]은 DEFA6가 세균 표면의 단백질에 결합하여 섬유(fibrils)를 생성하고, 나노망(nanonets)을 형성함으로써 세균을 에워싸 무력화 시킨다고 주장하였다. 이로써 DEFA6가 명확한 살균 작용기전은 없지만, 생체 내외에서 장내 병원체에 의한 침입에 대한 보호 기능을 한다고 하였다. 방광암 세포에서 alpha defensin의 발현이 증가하였고, 특히 침습성 종양에서 확실하게 증가하는 것을 확인하였다. Alpha defensin은 섬유 아세포와 상피 세포에 대한 자기 mitogenicity 를 통해 상처 치유에도 관여한다고 알려져 있다[29]. 방광암 세포주인 T24, A498에는 alpha defensin이 증가된 반면, J82의 경우는 발현이 안되어 있었는데, 과발현된 경우에 종양의 공격성이 더 높은 것으로 확인되었다. 방광암에서 alpha defensin이 증가한 경우 세포 내에 칼슘 이온의 증가를 보이는데, 이것이 세포 내 신호전달을 활성화 시켰을 가능성과 세포의 이주성을 강화시킨 원인이 되었을 가능성이 있다[14].
외인성 defensin (exogenous–defensin)에 대한 반응의 차이는 서로 다른 세포에서 세포 신호 경로의 선천적 특성을 설명할 수 있으며, 이것은 환자의 종양에도 적용할 수 있다. 정상적인 세포에서 칼슘 이온의 정상 범위를 유지하려는 많은 기전이 있다. 이전 연구들에서 alpha defensin이 종양세포에서 칼슘 이온 등의 생물학적 활성 이온에 대한 세포막 투과성 조절 같은 공통 기전을 갖는다고 하였다. 그리고, alpha defensin은 세포막에 구멍을 내기 때문에, alpha defensin 에 노출되면 종양 세포막의 비특이적 투과성을 증가시켜 칼슘 이온을 유입시킨다. 칼슘 이온 농도는 종양 성장과 확산을 포함한 여러 과정에서 중요한 생물학적 신호전달체계를 활성화 시킨다. 칼슘 이온 농도는 종양 세포의 막간 신호전달과 관련되어 있기 때문에, 여러 신호전달체계를 공통적으로 활성화 시키게 된다[30].
본 연구에서는 DEFA6의 발현이 T병기가 높은 군, 림프절 전이 및 혈관침습이 있는 군에서 더 흔하게 관찰되었다. 즉, DEFA6이 과발현된 대장암에서 종양의 침습성과 전이와 상관 관계가 있음을 알 수 있었다. 이는 종양의 확장과 전이를 위해서 주변 세포의 직접적인 손상 및 연결의 약화를 일으키는 과정을 DEFA6가 유도했을 가능성을 제시한다. 따라서 DEFA6는 종양세포 성장을 촉진하거나 종양세포 사멸을 일으킬 수 있으며, 신생혈관생성을 억제하는 등 면역조절을 통해 종양 성장에서 복합적인 역할을 하는 것으로 보인다.
본 연구의 결과로서 대장암 조직직에서 발현된 DEFA6는 대장암의 침습성 및 공격성과 관련이 있으며 대장암 환자의 생존율과도 관련이 있음을 확인하여 향 후 이를 대장암의 예후 예측인자로 활용할 수 있을 것으로 생각한다.






