대장암 환자의 혈장 carcinoembryonic antigen (CEA)와 세포내 CEA 염색패턴의 상관관계와 예후 분석
ABSTRACT
Purpose:
The aim of this study was to investigate the prognostic factor for elevating serum carcinoembryonic antigen (CEA) in patients with colorectal cancer and to identify clinical usefulness of tissue CEA.
Methods:
Two hundred and eighty-five patients with colorectal cancer were performed serum CEA tests before and after surgery. Also resected tumors were checked expressions pattern of tissue CEA. Clinicopathologic factors were classified according to patient factors, tumor factors and molecular factors. Patient factors included age, sex, underlying liver disease, smoking history and other cancer history. Tumor factors included tumor size, intestinal obstruction, pathologic T status, lymph node metastasis, tumor differentiation, lymphatic invasion, vascular invasion, perineural invasion.
Results:
Serum CEA level was markedly elevated in the cytoplasmic pattern of tissue CEA compared to membranous pattern of tissue CEA. As cancer stage progressed, serum CEA level was elevated, which was confined to cytoplasmic pattern of tissue CEA. Independent factors for the elevation of serum CEA by multivariate analysis included tumor size ( ≥ 5 cm) (P = 0.042), complete intestinal Obstruction (P = 0.023) and serum CA 19-9 ( ≥ 37 U/mL) (P = 0.027). p53 overexpression ( ≥ 10%) was related to cytoplasmic pattern in tissue CEA (P = 0.005).
Conclusion:
The tumor size and bowel obstruction are considered the main factors, which cause the leakage of intracellular CEA. And membranous patterns of tissue CEA can be used in Stage I colorectal cancer patients, as an indicator for early prognosis and recurrence. However, more studies of colorectal population are required for further evaluation.
Keywords: Colorectal cancer, Serum CEA, Tissue CEA
서 론
태아 종양 항원(carcinoembryonic antigen, CEA)은 태아의 장관과 성인 암세포 조직에서 특이하게 발현하는 종양 특이항원으로서 1965년에 Gold와 Freedman [ 1]에 의해 처음 기술되었다. 그러나, 정상 성인의 대장점막에서도 CEA가 생성되며, 대장암의 CEA와 정상 대장의 CEA는 동일한 생화학적 구조와 기능을 가졌다[ 2, 3]. 정상인에서도 대장의 장관내로 CEA는 분비되어 하루에 대변으로 50–70 mg 가량의 CEA가 배출된다[ 4]. CEA는 세포 부착 물질(cell adhesion molecule)로서 기능을 하며, 분자 수용기 복합체로서 작용하여 신호 전달 및 조절(signal transduction and regulation)에도 관련되어 있다. 그리고 대장 내강에서 장내 유해세균을 흡착시켜 배설되도록 하여 대장점막을 보호하는 면역 방어 기능도 가지고 있다. 특히 CEA는 면역 글로불린 연관 단백질들과 구조가 유사하며 혈액내 암세포가 간의 Kupper cell과 결합하는 데 도움을 주어 대장암 세포의 간전이 과정에서 세포 부착 물질의 역할을 할 것으로 생각된다[ 4]. 현재 혈장 CEA는 대장암 수술 후 재발을 감시하기 위한 종양 표지자로 채택되어 유용하게 이용되고 있다[ 3]. 그러나 혈장 CEA는 대장암 환자마다 변동폭이 다양하여 대장암의 선별검사로서는 부적합한 검사법으로 되어있다[ 5]. 그리고 혈장 CEA는 대장암 환자의 장기 종양학적 예후를 일관적으로 반영하지는 못하였다. 이러한 넓은 변이 폭을 가진 혈장 CEA는 간질환, 흡연, 폐질환 등 여러 임상적 변수들에 영향을 받기 때문에 대장암 진단과 예후 예측을 위한 특이적인 종양 표지자로서 한계를 가지고 있다[ 6]. 대장암 조직에 축적된 조직 CEA는 종양 고유의 성상을 파악하고 대장암의 예후를 예측하는 데 혈장 CEA보다 유용하다[ 7]. 또한 조직 CEA는 간질환, 흡연 등의 임상적 변수와의 관련성이 적어 상대적으로 안정적인 종양 표지자의 역할을 할 수 있을 것으로 예측된다. 그러나 대장암 환자에서 혈장 CEA의 상승이 다양한 양상으로 나타나는 것과 대장 세포내 CEA 농축 간의 연관성에 대한 연구는 부족하였다. 이에 저자들은 대장암 환자에서 혈장 CEA의 상승과 세포내 CEA 농축의 상관관계를 밝히고 혈장 CEA의 분비와 관련된 임상인자를 찾아보고자 하였다. 그리고 혈장 CEA와 세포질내 CEA 농축 양상이 대장암 환자의 장기 생존율에 미치는 영향을 분석하고자 하였다.
방 법
2010년 1월부터 2011년 8월까지 양산부산대학교병원 외과에서 대장 절제수술을 시행받은 285명의 대장암 환자를 대상으로 하였다. 모든 대장암 환자에 있어서 수술 전 혈장 CEA를 측정하였고 수술 후 적출된 종양의 병리조직에 면역 조직 화학 염색을 시행하여 조직 CEA 발현 패턴을 조사하였다.
CEA 면역조직화학염색법
면역염색을 위해 대표적인 암조직 블록을 선택하여 4 μm 두께로 박절하여 poly-L-lysine으로 처리한 슬라이드에 부착하였다. Bond-max 전자동 면역염색기(Leica, Wetzlar, Germany)에서 citrate 완충액을 사용하여 항원노출을 하였으며, Bond Polymer Intense Detection kit (Catalog No. DS9588, Leica)와 함께 발색제는 diaminobenzidine (Leica)을 사용하였다. CEA 일차항체는 mouse monoclonal antibody (clone: II-7, DAKO, Glostrup, Denmark)를 이용하였다.
혈장 CEA는 절단값(cut-off value)을 5 ng/mL로 규정하여 5 ng/mL 이상의 환자군은 높은 혈장 CEA군으로, 5 ng/mL 미만의 환자군은 정상 혈장 CEA군으로 분류하였다. 조직 CEA는 10% 이상의 종양세포에서 세포질 양성을 보이는 경우를 세포질형으로 간주하였으며, 10% 이하의 암세포가 세포질 염색을 나타내거나, 세포막 염색을 보이는 경우, 혹은 염색이 되지 않는 경우는 세포막형으로 분류하였다( Fig. 1). 혈장 CEA 상승에 관여하는 임상적 요인들과 조직 CEA 염색 패턴과의 연관성을 확인하기 위해 환자 요인, 종양 요인, 그리고 분자생물학적 요인으로 구분하여 여러 임상병리학적 인자들을 조사하였다. 환자 요인으로는 나이, 성별을 비교 분석하였으며 대장암 이외 혈장 CEA 수치에 영향을 준다고 알려진 간질환, 흡인력, 암 병력들을 함께 조사하였다. 간질환은 간염 및 간경화의 유무에 따라 정하였다. 종양 요인으로 종양 크기(최대 직경), 대장 폐색, T 병기, 림프절 전이, 암 병기, 분화도, 림프관/혈관/신경관 주위 침범 유무를 비교 분석하였다. 대장 폐색은 대장내시경 통과가 어려운 경우로 규정하였고 장 내용물의 통과가 일부 가능한 경우는 부분 폐색, 불가능한 경우는 완전 폐색으로 구분하여 조사하였다. 그리고 병기는 American Joint Committee on Cancer 7th를 이용하였다. 마지막으로 분자생물학적 요인으로서 혈중 CA 19-9, p53 과발현, K-RAS 변이, B-RAF 변이, microsatellite instability (MSI), epidermal growth factor receptor (EGFR) 과발현을 포함하여 조사하였다.
추적 진료는 수술 후 24개월까지 3개월마다 혈장 CEA, 대변 잠혈 검사를 시행하였고 흉부 단순 촬영은 6개월 간격으로 시행하였으며 대장내시경, 복부 computed tomography는 매년 시행하였다. 수술 후 2–5년째 추적 검사는 6개월마다 시행하였다. 수술 5년 이후 재발과 원격전이의 평가를 위한 진료는 매년 1회 시행하였다.
사망은 의무기록과 전화면담으로 확인했다. 무병생존율은 국소전이, 원격전이, 재발 소견 없이 사망한 기간을 기준으로 하였다. 국소 재발은 복강과 골반 내에 영상학적, 병리학적 재발 소견이 발견될 경우로 가정하였다. 원격전이는 복강과 골반 외에 영상학적, 병리학적 전이 소견이 발견될 경우로 가정하였다.
통계학적 처리방법은 Windows용 IPSS ver. 22.0 (IBM Corp., Armonk, NY, USA)을 이용하였으며 연속변수에 대해서는 Student’s t-test를 사용하였고 범주형 변수에 대해서는 chi-square test와 Fisher’s exact test를 사용하여 분석하였다. 그리고 로지스틱 회귀모델을 이용하여 다변량 분석을 시행했다. 생존율 분석에는 Kaplan-Meier curves, Cox regression test를 이용하였으며 무병생존율 비교를 위해 log rank test를 사용하였다. 통계 결과는 P값이 0.05 이하인 경우를 유의한 것으로 간주하였다.
결 과
혈장 CEA군과 조직 CEA군 염색 패턴과의 관계
높은 혈장 CEA 환자는 12.7%였고, 세포질형 CEA 환자는 87.3%였다. 세포질형 CEA 환자에서 세포막형 CEA 환자에서보다 혈장 CEA가 유의하게 높았다(P = 0.001).
대장암 병기가 높아질수록 높은 혈장 CEA 환자와 세포질형 CEA 환자 비율이 유의하게 증가하였다.
조직 CEA의 염색 패턴에 따른 혈장 CEA를 비교해본 결과, 세포막형 CEA군에서 병기가 높아져도 혈장 CEA의 상승은 두드러지지 않았다(P = 0.148). 그러나 세포질형 CEA 환자군에서는 병기에 따라 혈장 CEA가 상승하였으며, 병기 4기에서는 현저히 높은 수치를 보 였다(P < 0.001) ( Table 1).
임상병리학적 요인에 따른 혈장 CEA 수치와 조직 CEA 염색 패턴
단변량 분석에서 높은 혈장 CEA는 종양 크기(5 cm), 대장 폐색, T 병기, 림프절 전이, 신경침범, 병기, 그리고 혈장 CA19-9 ( ≥ 37 ng/mL)과 통계적 관련이 있었다.
세포질형 CEA는 병기, 림프절전이, 림프관침범, 신경침범, 그리고 p53 과발현( ≥ 10%)과 관련이 있었다( Table 2). 다변량 분석에서 높은 혈장 CEA는 혈장 CA 19-9 ( ≥ 37 ng/mL), 종양 크기( ≥ 5 cm), 나이, 신경침범, 그리고 p53 과발현과 통계적 상관성이 있었으며, 세포질 CEA는 p53 과발현, 높은 혈장 CEA, 신경침범과 유의한 관계가 있었다( Table 3). 조직 CEA 패턴에 따른 분석에서 세포질형 CEA 환자군에서는 종양크기( ≥ 5 cm), 대장폐색, 높은 T병기 등이 높은 혈장 CEA와 관련있는 인자였다. 그리고 세포막형 CEA 환자군에서는 종양크기( ≥ 5 cm)가 높은 혈장 CEA와 관련이 있었다( Table 4). 혈장 CEA를 상승시키는 요인으로 알려진 임상 조건인 흡연, 간질환 그리고 폐질환은 본 연구에서 혈장 CEA의 상승과 통계적 유의성이 없었다.
생존율 분석
조직 CEA 염색 패턴에 따라 5년 무병생존율을 분석한 결과 세포막형은 90%, 세포질형은 85.2%로 나타났다(P = 0.318). 혈장 CEA 수치에 따른 5년 무병생존율은 정상 혈장 CEA군에서는 90.1%, 높은 혈장 CEA군에서는 81% 로 나타났다(P = 0.034).
5년 무병생존율을 병기별로 분류하여 분석한 결과 병기 1기(n = 44), 병기 2기(n = 101), 병기 3기(n = 64)에서 각각 93.6%, 91.0%, 76.2%로 나타났다. 병기 1기에서 세포막형 CEA 환자는 100% 생존하였고 세포질형 CEA 환자는 90.3% 생존하여 차이를 보였으나 통계적 유의성(P = 0.221)에 도달하지는 못하였다( Fig. 2A, B). 병기 3기에서는 세포막형 CEA 환자는 71.4%, 세포질형 CEA환자 77.1%의 생존율을 보였다(P = 0.759). 혈장 CEA 수치에 따른 생존율은 정상 혈장 CEA군은 84.1%, 높은 혈장 CEA군은 67.59% (P = 0.081)로 통계적 유의성에 근접한 결과를 보여 병기 3기에서 혈장 CEA가 상승한 경우 생존율이 낮아지는 경향을 보였다( Fig. 2E, F). 무병생존율과 관련 있는 인자로는 림프절전이(P = 0.039)와 대장폐쇄(P = 0.058)가 있었다( Table 5).
고 찰
정상인에서 대장세포가 생성한 CEA는 대장내강을 면하는 세포막에서만 발현하여 대장 내강으로 분비되고 대장점막하층의 혈관으로는 유입되지 않아 혈장 CEA의 농도 상승은 없다[ 4]. 그러나 대장암 환자에서는 대장암 세포의 극성 소실로 인하여 세포막 전반에 걸쳐 발현한 CEA가 인접한 혈관으로 유입되어 혈장 CEA 농도를 상승시키는 것으로 알려져 있다[ 4, 8, 9]. 그러므로 대장암 세포의 CEA 발현이 높아질수록 혈장 CEA는 상승할 것으로 기대된다. 본 연구에서 대장암 세포질에 CEA가 농축되는 경우 혈장 CEA는 유의하게 증가하였고 병기가 높아질수록 혈장 CEA 수치도 상승하였다. 그러나 세포막에 국한되어 CEA가 발현한 경우에는 혈장 CEA의 상승이 뚜렷하지 않았고 병기에 따라 혈장 CEA 수차가 의미 있는 차이를 보이지 않았다. 특히 전이성 대장암에서 세포질형 CEA 환자들에서만 현저한 혈장 CEA 상승을 확인할 수 있었고, 세포막형 CEA 환자들에서는 전이성 대장암임에도 불구하고 혈장 CEA는 정상범위였다.
본 연구에서 세포막에 CEA 발현이 없었던 경우는 없었는데, 이는 이전 Park 등[ 10]의 연구에서 CEA 세포막 발현이 없었던 경우가 20%–30%의 환자에서 발견된 것과는 대조적이다. 비발현형 CEA 염색 패턴을 확인할 수 없었던 이유는 면역조직화학염색 방법과 사용한 시약의 차이에 의한 염색 강도의 차이가 원인이었을 것으로 생각된다. 대장암의 세포극성의 소실에 따른 CEA의 세포막 발현뿐만 아니라 세포질내 CEA의 농축이 혈장 CEA의 상승의 전제조건이 될 수 있을 것으로 생각된다. 그러나 대장암에서 전체 세포막에 CEA가 발현되어 종양의 침윤도가 증가함에도 불구하고 혈장 CEA의 증가가 일정하게 일어나지 않는다[ 6]. 이러한 결과는 혈장 CEA 상승을 유발하는 원인은 전체 세포막의 CEA 발현 이외 다른 요인이 있음을 나타내는 인자가 있을 것으로 보인다. 본 연구에서 혈장 CEA의 상승과 관련 있는 임상적 인자는 세포질 내 CEA 농축과 함께, 나이( > 70세), CA 19-9 ( > 37 ng/mL), p53 과발현( ≥ 10%), 그리고 종양크기( > 5 cm) 등이었다. 특히, 대장암 세포의 CEA 염색 패턴에 따라 혈장 CEA 상승과 관련 있는 인자는 상이하였는데, 세포막형 CEA 환자들에서는 p53 과발현 그리고 종양 크기와 연관되어 있었다. 세포질형 CEA 환자들에서는 대장 폐쇄가 혈장 CEA 상승의 유발요인으로 나타났다. 이러한 결과는 세포 내 CEA의 패턴에 따라 혈장으로 CEA가 유출되는 경로에 차이가 있음을 시사하는 것으로 보인다.
본 연구에서 대장암의 세포질내에 CEA가 축적되어 있고 대장폐쇄와 같은 장관 내 압력이 상승하는 환경에서 혈장 내 CEA도 같이 증가된 결과를 보였다. 세포질내에 축적된 CEA가 혈액으로 유입되는 촉진인자로서 대장폐쇄가 영향을 준 것으로 보인다. 대장암이 대장 내강을 채우거나 대장을 수축시켜 장폐색을 유발시키게 되면 장관 내 물리적 압력이 올라가게 되고 대장암 암세포를 압착하는 효과(squeezing effect)를 가져와 대장암 세포의 CEA가 인접한 혈액으로 유입되어 혈장 CEA 농도의 상승을 가져올 수 있다. 그리고 대장폐색으로 인하여 대장 내용물의 정체가 발생하게 되면, 대장 내강으로 분비된 CEA의 재흡수가 증가하게 되어 혈장 CEA가 상승할 가능성도 있다. 혈장 CEA의 상승이 대장 폐색과 유의하게 연관되어 있다는 본 연구 결과는 아직 자세히 밝혀지지 않은 사실이다. Sugarbaker [ 11]은 4명의 대장암 폐색 환자에서 혈장 CEA가 상승하였다고 보고하였으나 이에 대한 추가 연구는 드물었다. 본 연구에서 CEA의 세포내 축적과 p53의 변이 단백의 축적이 상당한 연관성을 가지면서 동시에 일어나는 현상으로 나타났다. 종양 억제유전자인 p53의 변이는 대장암 환자의 약 60%에서 나타나는 것으로 알려져 있다[ 12]. p53 유전자의 변이가 일어나면 p53 단백질의 정상적인 세포내 분해작용이 방해를 받아 세포질내 축적이 일어나게 된다. 그러므로 p53의 과도한 세포질내 축적은 p53의 유전자 변이를 간접적으로 확인할 수 있는 유용한 방법이다[ 13]. 저자들이 확인한 바로는 대장암 세포에서 CEA의 세포내 축적과 p53의 변이 단백의 축적이 상당한 연관성을 보이는 결과는 아직 보고되지 않은 현상으로 생각된다. 종양억제유전자인 p53의 변이는 종양억제효과의 소실에 그치는 것이 아니라, 종양 유발을 촉진하는 다양한 기능의 획득에도 관련되어 있다[ 12]. p53 변이 단백에 의하여 직접적으로 CEA의 생성을 촉진할 수 있고 p53과 CEA의 세포내 분해는 ubiqutilization에 의한 기전과 유사하여 경쟁적으로 세포질 내 CEA가 누적될 가능성도 있다. 대장암 초기 단계에 p53 변이가 일어나게 되면 다양한 경로를 통하여 종양의 악성도는 높아지게 되고 원격전이와 재발의 위험이 상대적으로 증가할 것으로 보인다[ 12- 16]. 이때 세포질내 CEA의 누적과 p53 유전자 변이 사이의 분자생물학적 관계와 이러한 변화가 초기 대장암의 전이에 어떤 영향을 미치는지에 대하여 향후 추가 연구가 필요할 것으로 보인다. 본 연구에서 혈장 CEA는 5년 무병생존율의 차이를 보였으나, 생존율과 관련된 인자는 아니었다. 조직 CEA 역시 통계적으로 유의한 예측인자는 아니었다.
림프절전이와 대장폐쇄는 무병생존율과 관련성 있는 인자로 나타났으며 이 같은 결과는 여러 연구자들이 보고하였다[ 17, 18]. 병기별로 무병생존율을 분석한 결과 병기 1기에서 세포막형 CEA 환자의 5년 무병 생존율은 100%였으나, 세포질형 CEA 환자의 생존율은 90.3%로 차이를 보여 주목할 필요가 있다.
지금까지 알려진 여러 예후인자들은 병기 1기인 초기 대장암의 예후를 예측하기에는 많은 한계를 가지고 있다. 본 연구에서는 병기 1기 대장암에서 암세포의 CEA 염색 패턴에 따라 무병생존율의 차이를 보이고 있다. 그러나 단일기관의 제한된 환자군을 대상으로 시행한 소규모 연구라는 한계가 있어 이러한 생존율의 차이는 통계학적인 유의성에 도달하지는 못하였다. 그러므로 초기 대장암의 예후 지표로서 암세포의 CEA 염색 패턴과 p53 변이의 가능성에 대한 평가를 위하여 다기관 연구가 필요할 것으로 생각한다. 향후 대장암의 예후 예측 및 재발감시에 조직 CEA와 혈장 CEA의 특성에 따라 활용될 수 있을 것으로 기대되며, 이를 위해서는 더 많은 연구가 진행되어야 하겠다.
본 연구는 다음과 같은 몇 가지 한계점을 지니고 있다.
첫째, 본 연구에서 혈장 CEA의 상승이 세포내 CEA의 과다 생성, 혹은 세포내 분해의 감소에 의한 것인지 세포내 CEA의 유출의 증가에 의한 것인지 확인할 수는 없었다. 이를 확인하기 위하여 대장암 조직내 CEA의 mRNA와 Glycosyl-Phosphatidyl-Inositol Phospholipase D 효소 등에 대한 추가 연구가 필요하다. 조직내 CEA의 mRNA를 분석하여 세포내 CEA 과다생성을 확인할 수 있다. 그리고 혈장 CEA를 상승시키는 대장 폐색과 종양 크기 등의 임상적 요인과 함께, 조직 CEA의 세포외 분비에 관여된다고 여겨지는 Glycosyl-Phosphatidyl-Inositol Phospholipase D 효소의 증가는 혈장 CEA를 상승시키는 요인이 될 수 있다.
둘째, 대장암 조직의 CEA 염색 패턴을 분류하는 방법이 다른 연구들과 다른 점은 결과 분석의 차이를 유발할 수 있다. Park 등[ 10]이 보고한 연구에서 세포막과 세포질형을 총 4개의 군(비발현, 정점형, 정점측방형, 범세포막형)으로 분류하였다. Ng 등[ 19]은 조직 CEA 염색패턴을 정점형, 세포질형, 기저형, 기질형으로 분류하였고 Nazato 등[ 20]은 정점형, 세포질형으로 하였다. 그러나 본 연구에서는 비발현형과 정점형 CEA는 관찰되지 않았기 때문에 세포막형과 세포질형 두 개의 형태로 분류하였다. 비발현형 CEA 염색 패턴을 확인할 수 없었던 이유는 면역조직화학염색 방법과 사용한 시약의 차이에 의한 염색 강도의 차이가 원인이었을 것으로 생각된다. 향후 시약과 면역형광염색방법을 표준화한 연구를 한다면 이러한 한계를 극복할 수 있을 것으로 본다.
셋째, 대장암 환자들은 수술적 치료가 요구되는 대장암을 가지고 있었고, 대장내시경적 절제가 가능한 초기 대장암 환자들이 연구에 포함되지 않았기 때문에 이전 연구자들의 결과와 달리 CEA 염색패턴의 세분화가 나타나지 않았을 가능성도 배제할 수 없다[ 10]. CEA의 세포내 분포는 암의 분화도와 관련이 있다[ 2]. 분화도가 좋은 암에서는 세포막에 CEA가 분포하지만, 중등도 및 저위 분화도의 경우는 세포질에 CEA가 분포하게 된다. 넷째, 본 연구에 세포질내 CEA의 농축이 병기 1기 환자에서 재발 예후인자로서의 가능성을 발견하였으나, 환자군의 수가 적어 통계적 유의성에 이르지는 못하였다. 특히 대장암 병기 1기 환자에서 내시경적 치료를 받은 환자를 함께 생존 분석한다면, 조직 CEA 염색 패턴의 예후인자로서의 가치를 보다 정확하게 평가할 수 있을 것으로 생각한다.
본 연구에서 대장암 세포질내 CEA가 축적된 환자에서 종양의 침윤 깊이와 대장 폐색과 같은 물리학적 부하가 세포질의 CEA를 혈장으로 유출시키는 것으로 보인다. 그리고 병기에 따라 조직 CEA와 혈장 CEA는 각각 다른 양상으로 예후를 반영하는 것으로 보인다.
CONFLICT OF INTEREST
No potential conflict of interest relevant to this article was reported.
ACKNOWLEDGMENTS
This work was supported by the year 2015 clinical research grant from Pusan National University Hospital.
REFERENCES
2. Ahnen DJ, Nakane PK, Brown WR. Ultrastructural localization of carcinoembryonic antigen in normal intestine and colon cancer:abnormal distribution of CEA on the surfaces of colon cancer cells. Cancer 1982;49:2077-90.   3. Hamada Y, Yamamura M, Hioki K, Yamamoto M, Nagura H, Watanabe K. Immunohistochemical study of carcinoembryonic antigen in patients with colorectal cancer. Correlation with plasma carcinoembryonic antigen levels. Cancer 1985;55:136-41.   4. Hammarstrom S. The carcinoembryonic antigen (CEA) family: structures, suggested functions and expression in normal and malignant tissues. Semin Cancer Biol 1999;9:67-81.   6. Duffy MJ. Carcinoembryonic antigen as a marker for colorectal cancer: is it clinically useful? Clin Chem 2001;47:624-30.  7. Nakagoe T, Sawai T, Ayabe H, Nakazaki T, Ishikaw H, Hatano K, et al. Prognostic value of carcinoembryonic antigen (CEA) in tumor tissue of patients with colorectal cancer. Anticancer Res 2001;21:3031-6.  8. Tobioka H, Isomura H, Kokai Y, Sawada N. Polarized distribution of carcinoembryonic antigen is associated with a tight junction molecule in human colorectal adenocarcinoma. J Pathol 2002;198:207-12.   9. Lawrence N, Hinder V, Murray M, Macapagal J, Thompson P, Sharples K, et al. Transient elevation in serum carcinoembryonic antigen while on adjuvant chemotherapy for colon cancer: is this of prognostic importance? Asia Pac J Clin Oncol 2015;Aug. 6. [Epub]. http://dx.doi.org/10.1111/ajco.12402.  10. Park JW, Chang HJ, Kim BC, Yeo HY, Kim DY. Clinical validity of tissue carcinoembryonic antigen expression as ancillary to serum carcinoembryonic antigen concentration in patients curatively resected for colorectal cancer. Colorectal Dis 2013;15:e503-11.
12. Hsieh JS, Lin SR, Chang MY, Chen FM, Lu CY, Huang TJ, et al. APC, K-ras, and p53 gene mutations in colorectal cancer patients: correlation to clinicopathologic features and postoperative surveillance. Am Surg 2005;71:336-43.  13. Diez M, Pollan M, Muguerza JM, Gaspar MJ, Duce AM, Alvarez MJ, et al. Time-dependency of the prognostic effect of carcinoembryonic antigen and p53 protein in colorectal adenocarcinoma. Cancer 2000;88:35-41.   14. Diez M, Medrano M, Muguerza JM, Ramos P, Hernandez P, Villeta R, et al. Influence of tumor localization on the prognostic value of P53 protein in colorectal adenocarcinomas. Anticancer Res 2000;20:3907-12.  15. Gasser M, Gerstlauer C, Grimm M, Bueter M, Lebedeva T, Lutz J, et al. Comparative analysis of predictive biomarkers for therapeutical strategies in colorectal cancer. Ann Surg Oncol 2007;14:1272-84.   16. Tang R, Yeh CY, Wang JY, Changchien CR, Chen JS, Hsieh LL. Serum p53 antibody as tumor marker for follow-up of colorectal cancer after curative resection. Ann Surg Oncol 2009;16:2516-23.   17. Katoh H, Yamashita K, Wang G, Sato T, Nakamura T, Watanabe M. Prognostic significance of preoperative bowel obstruction in stage III colorectal cancer. Ann Surg Oncol 2011;18:2432-41.   18. Derwinger K, Carlsson G, Gustavsson B. A study of lymph node ratio as a prognostic marker in colon cancer. Eur J Surg Oncol 2008;34:771-5.   19. Ng IO, Ho J, Pritchett CJ, Chan EY, Ho FC. CEA tissue staining in colorectal cancer patients--correlation with plasma CEA, histology and staging. Pathology 1993;25:219-22.   20. Nazato DM, Matos LL, Waisberg DR, Souza JR, Martins LC, Waisberg J. Prognostic value of carcinoembryonic antigen distribution in tumor tissue of colorectal carcinoma. Arq Gastroenterol 2009;46:26-31.  
Fig. 1.
Tissue carcinoembryonic antigen (CEA) expression pattern. (A) Membranous type: CEA is stained along the cytoplasmic membrane or confined to apical border. (B) Cytoplasmic type: Carcioma cells are strongly positive in their cytoplasm for CEA. (C) Colonic adenoma as control staining: stained along the apical membrane. Immunohistochemistry of tissue CEA: primary antibody (clone: II-7, DAKO, Glostrup, Denmark). 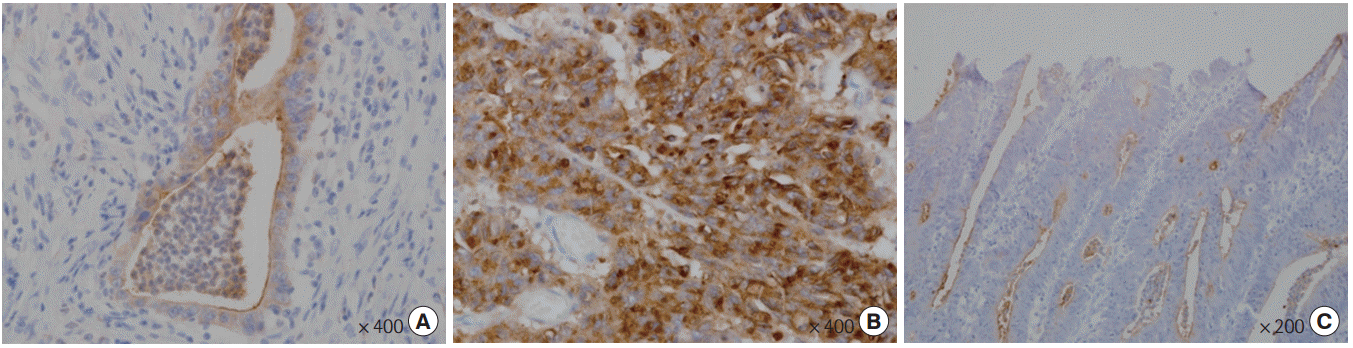
Fig. 2.
Five-year disease free survival of Colorectral cancer according to tissue carcinoembryonic antigen (CEA) stain pattern and serum CEA level. (A) Stage I tissue CEA. (B) Stage I serum CEA. (C) Stage II tissue CEA. (D) Stage II serum CEA. (E) Stage III tissue CEA. (F) Stage III serum CEA. 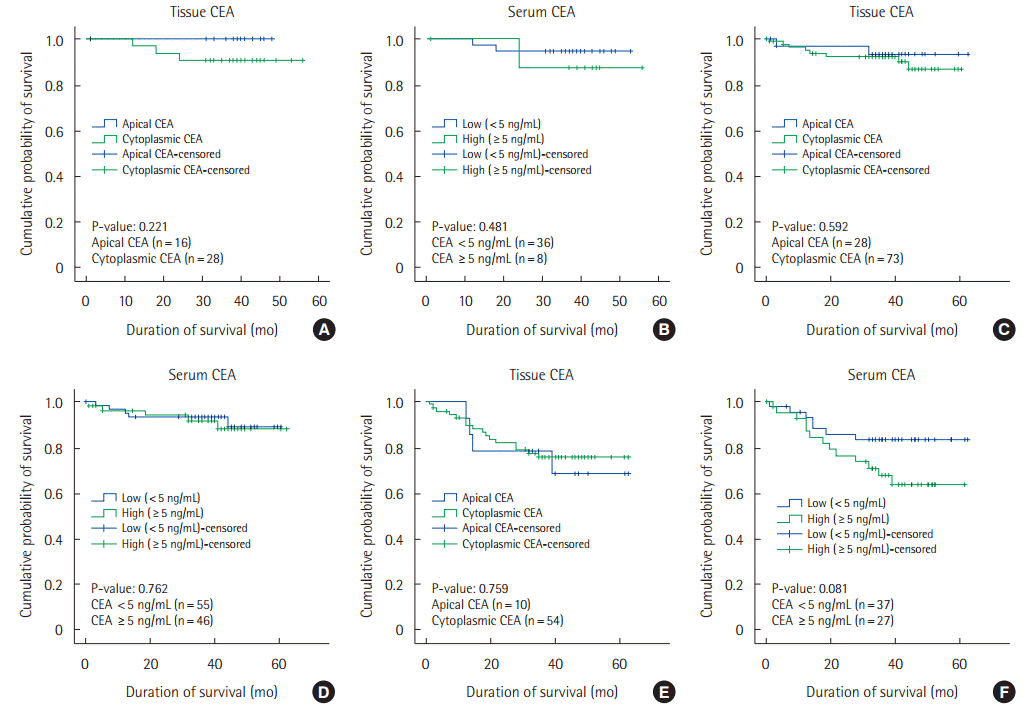
Table 1.
The relationship between serum CEA level of each tissue CEA and cancer stage
|
Stage |
Serum CEA of tissue CEA
|
|
Membranous type (ng⁄mL) |
Cytoplasmic CEA (ng⁄mL) |
|
Stage I |
3.4 ± 3.1 |
3.6 ± 2.7 |
|
Stage II |
4.5 ± 4.2 |
20.5 ± 74.3 |
|
Stage III |
12.8 ± 25.1 |
13.1 ± 27.4 |
|
Stage IV |
3.9 ± 1.1 |
170.0 ± 15.7 |
|
P-value |
0.148 |
< 0.001 |
Table 2.
Serum CEA level and tissue CEA staining pattern according to clinicopathologic characteristics
|
Characteristic |
Serum CEA
|
Tissue CEA
|
|
Normal CEA (<5 ng/mL) |
High CEA (≥5 ng/mL) |
P-value |
Membranous type |
Cytoplasmic type |
P-value |
|
Tumor size |
|
|
< 0.001 |
|
|
0.611 |
|
< 5 cm |
91 (57.2) |
44 (34.9) |
|
32 (50.0) |
103 (46.4) |
|
|
≥ 5 cm |
68 (42.8) |
82 (65.1) |
|
32 (50.0) |
119 (53.6) |
|
|
Colon obstruction |
|
|
< 0.001 |
|
|
0.296 |
|
No |
114 (71.7) |
62 (49.2) |
|
38 (59.4) |
138 (62.2) |
|
|
Partial |
39 (24.5) |
51 (40.5) |
|
24 (37.5) |
67 (30.2) |
|
|
Complete |
6 (3.8) |
13 (10.3) |
|
2 (3.1) |
17 (7.7) |
|
|
Pathologic T status |
|
|
< 0.001 |
|
|
0.205 |
|
pT1 |
11 (6.9) |
3 (2.4) |
|
3 (4.7) |
11 (5.0) |
|
|
pT2 |
36 (22.6) |
7 (5.6) |
|
15 (23.4) |
28 (12.6) |
|
|
pT3 |
91 (57.2) |
92 (73.0) |
|
37 (57.8) |
146 (65.8) |
|
|
pT4 |
21 (13.2) |
24 (19.0) |
|
9 (14.1) |
37 (16.7) |
|
|
Lymph node metastasis |
|
|
0.003 |
|
|
0.007 |
|
Negative |
101 (63.5) |
58 (46.0) |
|
45 (70.3) |
114 (51.4) |
|
|
Positive |
58 (36.4) |
68 (54.0) |
|
19 (29.7) |
108 (48.6) |
|
|
Cancer stage |
|
|
< 0.001 |
|
|
0.005 |
|
I |
37 (23.3) |
9 (7.1) |
|
16 (25.0) |
30 (13.5) |
|
|
II |
61 (38.4) |
49 (38.9) |
|
30 (46.9) |
80 (36.0) |
|
|
III |
46 (28.95) |
42 (33.3) |
|
15 (23.4) |
73 (32.9) |
|
|
IV |
15 (9.4) |
26 (20.6) |
|
3 (4.7) |
39 (17.6) |
|
|
Differentiation |
|
|
0.071 |
|
|
0.705 |
|
Well |
21 (13.3) |
7 (5.6) |
|
8 (12.5) |
20 (9.0) |
|
|
Moderate |
127 (80.4) |
113 (89.7) |
|
52 (81.3) |
188 (85.1) |
|
|
Poor |
10 (6.3) |
6 (4.8) |
|
4 (6.3) |
13 (5.9) |
|
|
Lymphatic invasion |
|
|
0.068 |
|
|
0.030 |
|
Negative |
141 (88.7) |
102 (81.0) |
|
60 (93.8) |
184 (82.9) |
|
|
Positive |
18 (11.3) |
24 (19.0) |
|
4 (6.3) |
38 (17.1) |
|
|
Vascular invasion |
|
|
0.299 |
|
|
0.060 |
|
Negative |
147 (92.5) |
112 (88.9) |
|
62 (96.9) |
198 (89.2) |
|
|
Positive |
12 (7.5) |
14 (11.1) |
|
2 (3.1) |
24 (10.8) |
|
|
Perineural invasion |
|
|
0.003 |
|
|
0.002 |
|
Negative |
131 (82.4) |
85 (67.5) |
|
58 (90.6) |
159 (71.6) |
|
|
Positive |
28 (17.6) |
41 (32.5) |
|
6 (9.4) |
63 (28.4) |
|
|
Serum CA 19-9 |
|
|
< 0.001 |
|
|
0.214 |
|
< 39 U/mL |
148 (94.3) |
92 (74.2) |
|
56 (90.3) |
184 (84.0) |
|
|
≥ 39 U/mL |
9 (5.7) |
32 (25.8) |
|
6 (9.7) |
35 (16.0) |
|
|
p53 overexpression |
|
|
0.624 |
|
|
0.030 |
|
< 10% |
27 (32.5) |
24 (36.4) |
|
33 (51.6) |
81 (36.5) |
|
|
≥ 10% |
56 (67.5) |
42 (63.6) |
|
31 (48.4) |
141 (63.5) |
|
Table 3.
Multivariate analysis of factors according to serum CEA and tissue CEA staining pattern
|
Factor |
Odds ratio |
95% Confidence interval |
P-value |
|
Serum CEA elevation |
|
|
|
|
Cytoplasmic tissue CEA |
2.970 |
1.461–6.039 |
0.003 |
|
Serum CA 19-9 (≥ 37 U/mL) |
5.260 |
2.238–12.361 |
< 0.001 |
|
Age |
1.034 |
1.008–1.061 |
0.010 |
|
Perineural invasion |
1.834 |
0.966–3.481 |
0.064 |
|
p53 overexpression (≥ 10%) |
0.460 |
1.461–6.039 |
0.006 |
|
Cytoplasmic CEA |
|
|
|
|
p53 overexpression (≥ 10%) |
1.982 |
1.056–3.720 |
0.033 |
|
High serum CEA (< 5 ng/mL) |
3.127 |
1.536–6.367 |
0.002 |
|
Perineural invasion |
2.927 |
1.105–7.753 |
0.031 |
Table 4.
Serum CEA level of each tissue CEA according to clinicopathologic characteristics
|
Characteristic |
Tissue CEA (Membranous type)
|
Tissue CEA (Cytoplasmic type)
|
|
Normal CEA (<5 ng/mL) |
High CEA (≥5 ng/mL) |
P-value |
Normal CEA (< 5 ng/mL) |
High CEA (≥ 5 ng/mL) |
P-value |
|
Tumor size |
|
|
0.083 |
|
|
0.001 |
|
< 5 cm |
27 (56.3) |
5 (31.3) |
|
64 (57.7) |
39 (35.5) |
|
|
≥ 5 cm |
21 (43.8) |
11 (68.8) |
|
47 (42.3) |
71 (64.5) |
|
|
Colon obstruction |
|
|
0.870 |
|
|
< 0.001 |
|
No |
29 (60.4) |
9 (56.3) |
|
85 (76.6) |
53 (48.2) |
|
|
Partial |
17 (35.4) |
7 (43.8) |
|
22 (19.8) |
44 (40.0) |
|
|
Complete |
2 (4.2) |
0 |
|
4 (3.6) |
13 (11.8) |
|
|
Pathologic T status |
|
|
0.207 |
|
|
0.001 |
|
pT1 |
2 (4.2) |
1 (6.3) |
|
9 (8.1) |
2 (1.8) |
|
|
pT2 |
14 (29.2) |
1 (6.3) |
|
22 (19.8) |
6 (5.5) |
|
|
pT3 |
25 (52.1) |
12 (75.0) |
|
66 (59.5) |
80 (72.7) |
|
|
pT4 |
7 (14.6) |
2 (12.5) |
|
14 (12.6) |
228 (20.0) |
|
Table 5.
Multivariate analysis of factors with disease free survival
|
Factor |
Odds ratio |
95% Confidence interval |
P-value |
|
Cytoplasmic Tissue CEA |
0.782 |
0.337–2.269 |
0.782 |
|
Serum CA 19-9 (≥ 37 U/mL) |
1.537 |
0.678–3.482 |
0.303 |
|
Lymph node metastasis |
2.400 |
1.045–5.515 |
0.039 |
|
Colon obstruction (complete) |
3.166 |
0.962–10.423 |
0.058 |
|
Lymphatic invasion |
1.718 |
0.585–5.050 |
0.325 |
|
Peineural invasion |
1.945 |
0.832–4.543 |
0.124 |
|
|







