30세 이하 산발성 대장암 환자의 임상 병리학적 특징
Clinicopathologic characteristics of patients with sporadic colorectal cancer under the age of 30
Article information
Trans Abstract
Purpose
The purpose of this study was to investigate the distinctive clinicopathologic features and oncological survival outcomes of sporadic colorectal cancer in patients under the age of 30 years old.
Methods
From 1994 to 2013, total 15,206 patients underwent curative or palliative surgery for sporadic colorectal cancer in our institution. 235 patients (1.5%) were under 30 years of age. Patients who presented with metachronous cancers, recurrent cancers, hereditary nonpolyposis colorectal cancer, familial adenomatous polyposis and patients without a microsatellite instability (MSI) analysis were excluded. A total 79 pateints who were ≤30 years old with sporadic colorectal cancer were enrolled.
Results
Seven patients (8.9%) had family history of colorectal cancer. Location of the tumor was 23 (29.1%) in right colon, 29 (36.7%) in left colon, 27 (34.2%) in rectum. Young patients tend to present with a higher incidence of mucinous and signet ring cell tumors (15.2%), poorly differentiated tumors (11.4%) and advanced stage such as Stage III (31.6%), Stage IV (30.4%). microsatellite instability-high (MSI-H) was observed in 10 (12.7%), microsatellite stable (MSS)/ microsatellite instability-low (MSI-L) in 69 (87.3%). 66.7% (n=6) of the MSI-H tumors showed loss of hMLH1 expression; no MSS/MSI-L tumors showed hMLH1 loss. 5 years ovarall survival was 72.8%. Stage specific overall survival was 100% for stage I, 100% for stage II, 75.9% for stage III, 31.4% for stage IV.
Conclusion
Patients with sporadic colorectal cancer under the age of 30 seem to have poor outcome than older patients, because of characteristic clinical and biological behaviors. Early detection of colorectal cancer (CRC) confers survival benefit to young patients.
서 론
대장암은 세계적으로 남성에서 3번째, 여성에서는 2번째로 흔한 암이며[1], 서구의 경우 대장암 관련 사망률은 약 33%에 이른다[2]. 최근 국내 역시 대장암 발생률이 증가하고 있으며, 전체 암 발생 중 12.3%를 대장암이 차지한다[3]. 선별 검사를 통한 조기 발견, 진단 및 치료 기술의 발전에도 불구하고, 여전히 대장암은 한국에서 암 관련 사망 원인의 4번째를 차지하고 있다[3]. 대장암은 청년층 보다는 노년층에서 특히 더 잘 발생하지만[4], 최근 젊은 연령에서의 대장암 진단이 늘고 있는 추세다[5].
지금까지 비교적 젊은 연령에서 발생하는 대장암에 대한 연구들이 있었으며, 젊은 연령층에서 발생된 대장암의 경우 진행된 병기, 불량한 조직학적 양상 등의 임상병리학적 특징을 가지는 것으로 보고하고 있다[6–9]. 그러나 연구마다 젊은 연령층에서 발생한 대장암의 기준 또한 다양하며, 대부분에서 청년층은 50세 이하[10,11] 또는 40세 이하[9,12,13]로 정의하였다. 연령과 생존율의 관계는 여전히 논란이 있으나, 대부분 청년층 환자의 생존율은 불량한 것으로 보고되며, 이는 젊은 연령층에서 발생하는 대장암은 노년층의 대장암과 다른 고유의 독특한 특성에 기인할 것으로 추정된다[14,15]. 따라서 청년층 대장암의 더 나은 진단과 치료를 위해서 청년층 대장암의 특 징에 대해 더 잘 이해해야 할 필요가 있다.
일반적으로 젊은 환자에서 발생하는 대장암의 경우, 린치 증후군과 같은 유전성 대장암과의 연관성이 제안되었으며, 유전성 대장암은 산발성 대장암과 다른 예후와 다른 생물학적 특징을 보인다. 이전의 보고들에서는 산발성 대장암과 유전성 대장암을 모두 포함한 연구가 많았다.
이 연구의 목적은 유전성 대장암을 제외한 30세 이하 청년층 산발적 대장암 환자의 분석을 통하여 젊은 연령층에서 발생한 대장암의 특징을 규명하고자 하였다.
방 법
1994년 9월부터 2013년 12월까지 삼성서울병원에서 대장암으로 수술 받은 총 15,206명의 환자들 중, 30세 이하 환자는 235명으로 전체의 1.5%를 차지하였다. 이 중 가족성 선종성 용종증과 암스테르담 기준[16]를 만족하는 유전성 비용종증 대장암은 제외한 후, 현미부수체 불안정성(microsatellite instability, MSI) 결과가 있고 일차성 대장암인 환자 79명만을 선별하여 분석하였다. 이들의 성별, 가족력, 종양 발생 부위, 종양의 크기, 진단 당시 전이 상태, 수술 후 재발 패턴 등 임상적 특징과 병기, 조직학적 분화도, 현미부수체 불안정성 등 병리학적 특징에 대해 후향적으로 검토 하였다. 병기 결정 방식은 American Joint Committee on Cancer (AJCC) 7th edition을 따랐다[17]. 가족력은 1도와 2도 가계 내(조부모, 부모, 형제, 자매, 자녀, 손자)에 대장암이 있는 경우 가족력이 있는 것으로 하였다. 근치적 수술이란 절제 단면에 잔여 종양을 남기지 않은 완전 절제의 경우이며, 보존적 수술이란 절제 수술 후에도 전이 병변을 포함한 잔존암이 남았거나 우회술, 장루형성술 등을 시행 한 경우이다. 발생 부위에서 우측 결장은 상행결장부터 비장굴곡결장까지, 좌측 결장은 하행결장부터 S결장 접합부까지, 직장 부위는 직장 및 S결장접합부 이하로 분류하였다. S결장 접합부에서 전방절제술을 한 경우는 좌측 결장으로 분류하고, 저위전방절제술을 시행한 경우에는 직장 부위로 분류하였다.
현미부수체 불안정성 분석(MSI test)은 외과적 절제술로 얻은 검체를 이용하여 각 환자의 종양 조직과 주변 정상 조직에서 DNA를 추출하여 시행하였다. 2010년 9월까지는 현미부수체 표지자(microsatellite marker)로 BAT-25, BAT-26, D2S123, D5S346, D17S250를 사용하였고[18], 그 이후에는 BAT25, BAT26, NR21, NR24, NR27를 사용하였다[19]. 중합 효소 연쇄 반응(polymerase chain reaction, PCR) 분석을 통하여 종양의 DNA와 정상 대장 점막에서 DNA를 비교하였다[20]. 5개의 현미부수체 표지자 중 적어도 2개에서 변이가 있는 경우 microsatellite instability-high (MSI-H)로 분류하였고, 1개의 표지자만 발현된 경우에는 microsatellite instability-low (MSI-L)로 분류하였다. 모든 현미부수체 표지자가 종양 조직과 정상 조직에서 동일한 패턴을 나타내는 경우는 microsatellite stable (MSS)로 분류하였다. 복제 오류 교정(mismatch repair, MMR) 단백질 발현(MLH1, MSH2 및 MSH6)은 복제 오류 교정 각 단백질에 특이적인 쥐의 단클론 항체(mouse monoclonal antibodies)를 사용하여 정상 및 종양 조직의 4 µm 두께의 파라핀 섹션에서 면역 조직 화학 염색에 의해 평가 하였다[21]. 복제 오류 교정 음성은 핵염색(nuclear staining)이 없거나 10% 미만일 때로 정의하였고, 양성은 10% 이상일 때로 정의하였다.
생존율은 수술 전 전이가 있는 경우, 보존적 수술을 시행한 경우, 수술 후 잔존암이 남은 경우 모두 포함하고 분석하였으나, 무병 생존율은 전이, 잔존암이 있는 경우와 보존적 수술을 한 경우는 제외하고 분석하였다. 통계학적 분석은 Window용 SPSS ver. 22 (IBM, Armonk, NY, USA) 프로그램을 이용하여 처리하였다. 생존분석은 카플란-마이어 생존분석(Kaplan-Meier study)을 이용했다.
결 과
임상적 특징
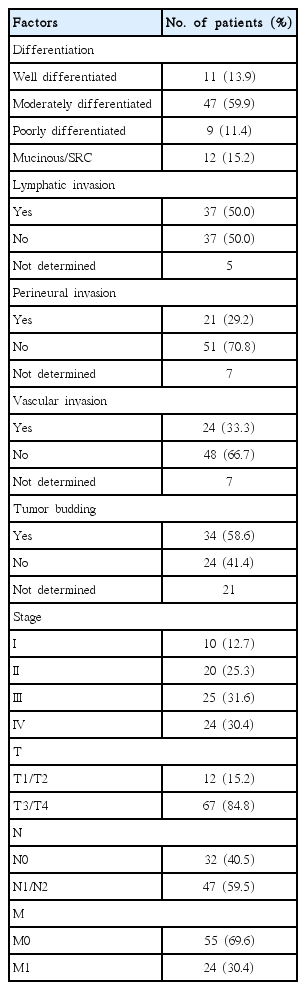
연령분포는 16세부터 30세까지였으며 10대 2명, 20대 53명, 30세 24명이었다. 평균 연령은 27.0세(표준 편차, ±3.23)이었다. 30세 이하 79명 중 남자는 39명(49.4%), 여자는 40명(50.6%)이었다. 수술 전 혈청 carcinoembryonic antigen 농도가 5.0 ng/mL 이하인 환자는 57명(75.0%), 5.0 ng/mL 초과인 환자가 19명(25.0%)이었다(3명은 결측). 가족력이 있는 경우는 총 7건(8.9%)으로, 1도 가족력이 있는 경우가 6건(7.6%), 2도 가족력이 있는 경우가 1건(1.3%)이었다. 근치적 수술을 시행 받은 환자는 64명(81.0%), 보존적 수술를 받은 환자는 15명(19.0%)이었다. 정규 스케쥴로 계획된 수술을 한 경우가 73건(92.7%)이었고, 응급 수술을 한 경우가 6건(7.6%)이었다. 수술 당시 장폐색이 있었던 환자는 25명(31.6%), 장천공이 있었던 환자는 4명(5.1%)이었다. 종양 발생 위치는 우측 결장이 23예(29.1%), 좌측 결장이 29예(36.7%), 직장부위가 27예(34.2%)이었다. 종양의 크기는 5.0 cm 이하인 경우가 36예(45.6%), 5.0 cm을 초과하는 경우가 43예(54.4%)였으며, 평균은 5.61 cm (표준편차 ±2.61)이었다(Table 1).
병기는 Stage I 10예(12.7%), Stage II 20예(25.3%), Stage III 25예(31.6%), Stage IV 24예(30.4%)로 3기가 가장 높은 빈도, 4기가 두 번째 빈도를 보였다. T stage는 T1이 4예(5.1%), T2가 8예(10.3%), T3 40예(51.3%), T4 26예(33.3%)로 T3, T4가 높은 비율을 차지하였다. N stage 는 N0인 경우가 32예(40.5%), N1 또는 N2인 경우가 47예(59.5%)였다. 원격 전이가 없는 M0 케이스는 55예(69.6%), 원격 전이가 있는 M1 케이스는 24예(30.4%)였다. 진단 당시 원격 전이 24건을 분석해본 결과, 간 전이 9예(11.4%), 복막 전이 8예(10.1%), 원격 림프절 전이 8예(10.1%), 난소 전이 5예(6.3%), 폐 전이 3예(3.8%) 순이었다(Table 2).
병리적 특징
조직학적 분화도는 저분화암 11예(13.9%), 중분화암 47예(59.5%), 고분화암 9예(11.4%), 점액암 및 인환세포암 12예(15.2%)로 중분화암이 가장 높은 빈도를 보였고, 점액암 및 인환세포암이 두 번째로 높은 빈도를 보였다. 림프관 침윤이 있는 경우는 37예(50.0%), 신경 침윤이 있는 경우는 21예(29.2%), 혈관 침윤이 있는 경우는 24예(33.3%), 종양세포발아(tumor budding)가 있는 경우는 34예(58.6%)이었다(Table 2).
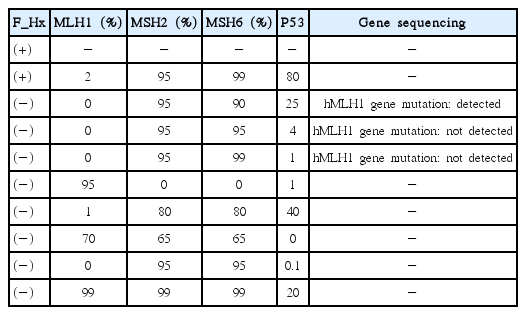
현미부수체 불안정성 분석(MSI test) 결과는 MSS 또는 MSI-L 인 경우가 69건(87.3%), MSI-H 인 경우가 10건(12.7%)이었다. 복제 오류 교정(MMR) 결과가 있는 69명 중 MLH1 양성은 64명(92.8%), MSH2 양성은 69명(98.6%), MSH6 양성은 68명(97.1%)이었다. MSS/ MSI-L 환자 69명 중 MLH1 양성은 61명(100%), MSH2 양성은 61명(100%), MSH6 양성은 60명(98.4%)이었다. MSI-H 환자 10명 중 MLH1 양성은 3명(33.3%), MSH2 양성은 8명(88.9%), MSH6 양성은 8명(88.9%)이었다(Table 3). 30세 이하 대장암 환자 중 MSI-H인 환자 10명 중 3명에서 유전자 시퀀싱 분석(gene sequencing study)이 시행되었으며, 이들의 면역조직검사 결과는 MLH1 유전자 발현 음성이었다. 이 중 1명에서 hMLH1 유전자 변이가 발견 되었다(Table 4).
예후
수술 전후 항암치료를 시행한 환자는 59명으로 전체의 74.7%를 차지하였고, 방사선 치료를 시행한 환자는 5명으로 전체의 6.3%를 차지하였다.
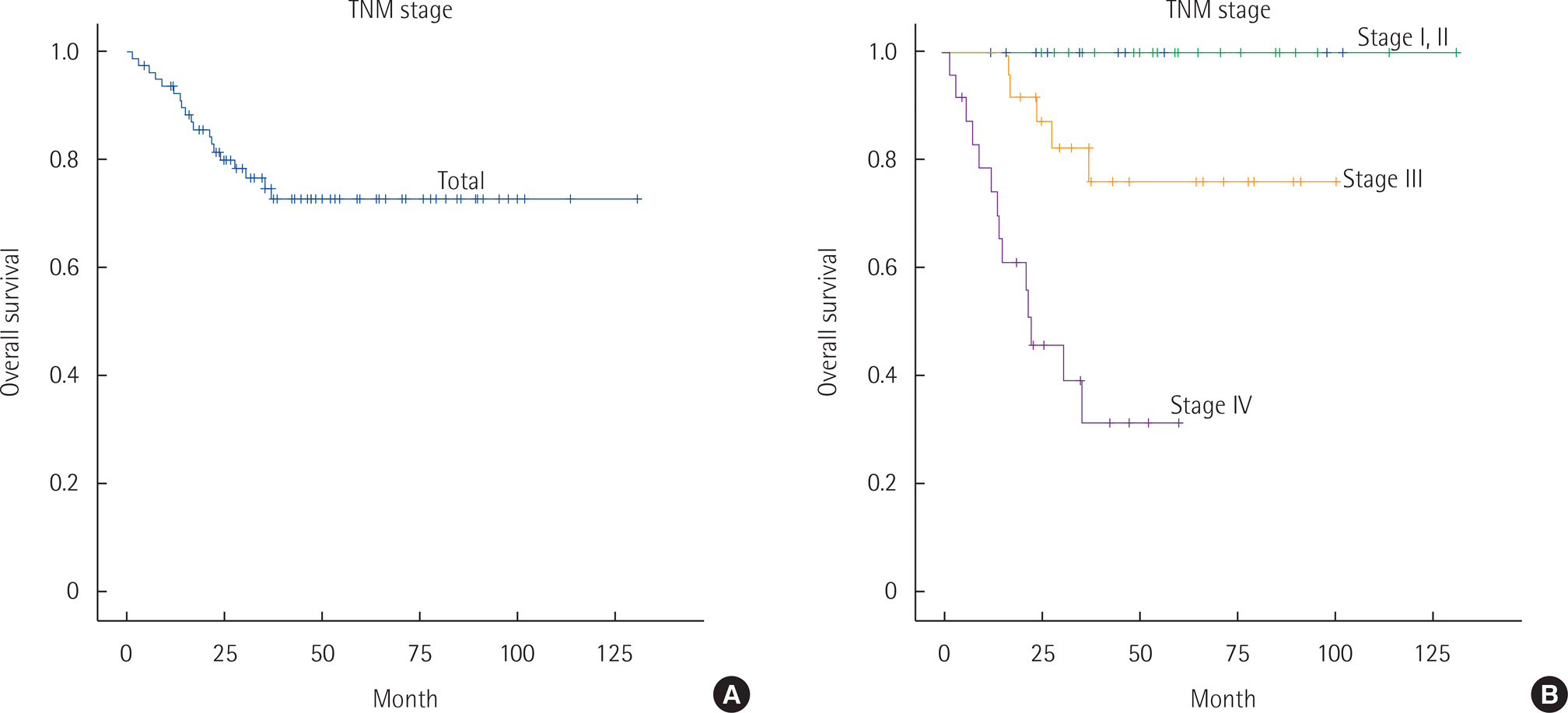
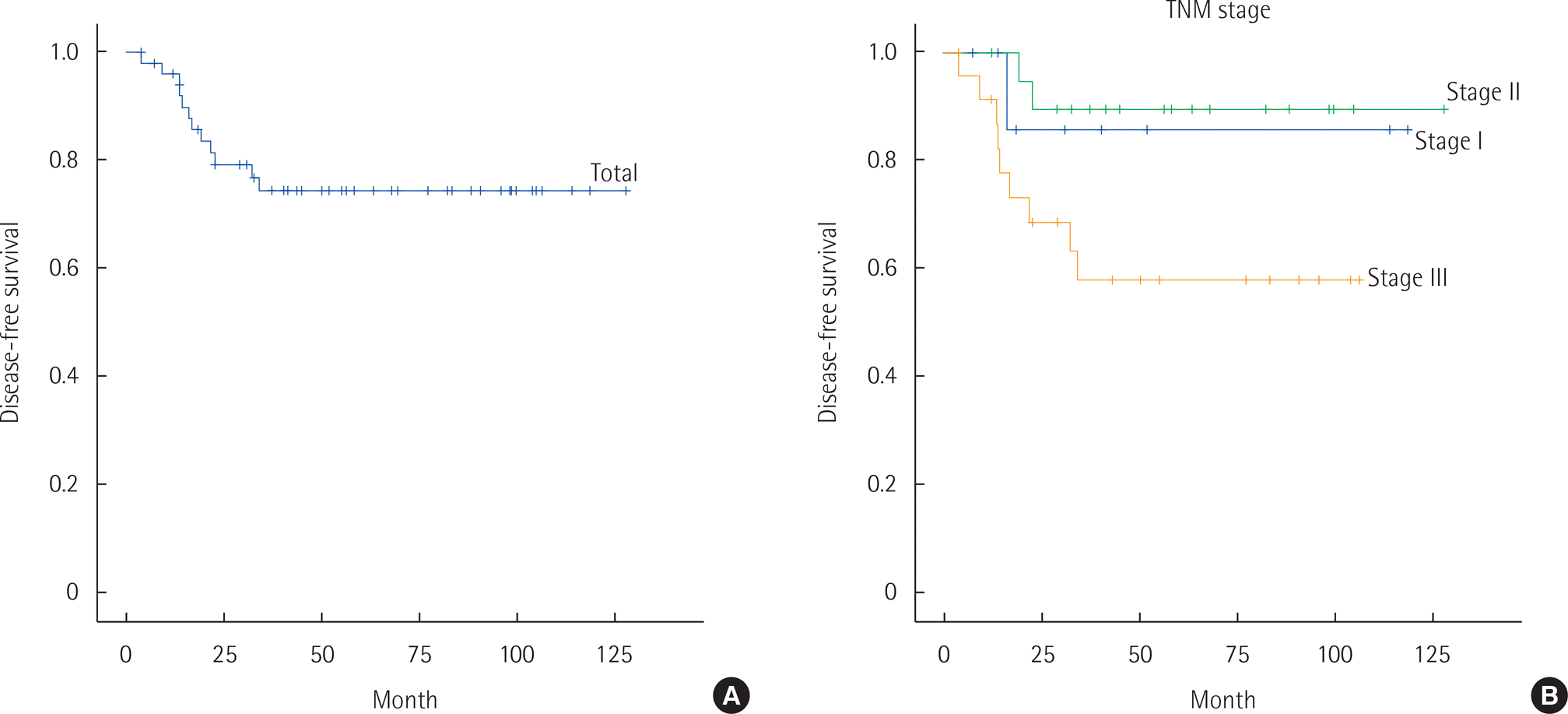
전체 생존율은 72.8%, 병기 별 생존율은 Stage I에서 100%, Stage II 100%, Stage III 75.9%, Stage IV 31.4% 였다(Fig. 1). 전체 5년 무병생존율은 74.5% 였고, 병기 별 5년 무병생존율은 Stage I에서 85.7%, Stage II 89.5%, Stage III 57.9%이었다(Fig. 2).
M0 환자에서 근치적 목적으로 R0 resection을 시행한 환자 52명 중 수술 후 재발이 있었던 환자는 총 12예(23.0%)로, 간 재발 4예(7.7%), 폐 재발 4예(7.7%), 복막 재발 2예(3.8%), 국소 재발 2예(3.8%) 관찰되었다.
고 찰
젊은 연령층에서 발생한 대장암에 대한 연구 및 보고는 많으나, 대부분 40대 혹은 50대를 기준으로 연구를 진행하였으며, 산발성 및 유전성 대장암을 구별하지 않고 모두 포함시켜서 보고되었다.
대부분의 보고 결과는 젊은 연령층에서 발생한 대장암의 경우 비교적 특징적인 임상병리적 양상을 보이고, 유전성 요인이 관여했을 가능성이 높고, 불량한 예후를 나타낸다. 이러한 연구는 젊은 연령층에서 발생한 대장암의 대략적인 임상적 특징 및 예후를 평가하는 데에 장점이 있으나, 젊은 연령층을 비교적 광범위하게 설정하거나 혹은 대상군을 대장암의 발생 평균연령 이하를 기준으로 하였으므로, 다른 특질의 대장암의 혼재되어 있을 가능성이 매우 크다. 하지만 10대, 20대에 발생한 대장암을 단독으로 연구하기에는 그 대상군이 매우 적으므로 이러한 연령층에 발생한 대장암의 연구는 거의 없는 실정이다. 이 연구는 비록 단일 기관의 연구지만 비교적 많은 수의 30대 이하 환자를 분석하였으며, 특히 그 발생원인과 예후가 비교적 잘 알려져 있는 유전성 대장암 환자를 제외하고, 산발성 대장암 환자만을 대상으로 하였다. 즉 아주 젊은 연령층에서 확인된 유전적인 요소 없이 발생하는 대장암의 특징을 분석하고자 하였다. 산발성으로 30세 이하 청년층 대장암 환자의 특성을 분석한 연구 중 본 연구의 대상군 이상을 보고한 연구는 드물다.
본 연구에서 젊은 산발성 대장암 환자는 다음과 같은 특징적인 임상 병리학적 특성과 결과를 보였다. 고분화암, 점액성암, 인환세포암과 같은 더 불량한 분화도의 암이 상대적으로 빈발하였으며, 이는 최근 Surveillance, Epidemiology and End Results 데이터베이스 연구결과와 동일하다[22]. 조직학적인 특징뿐만 아니라, 병기에서도 진 행된 상태에서 발견된 경우가 많아서 3기 31.6%, 4기 30.4%로 높은 비율을 차지하였다. 279,623명의 대장암 환자를 분석한 코호트 연구에서 젊은 환자(40세이하)의 진행 병기 비율은 3기 32.5%, 4기 24.4%로 다른 연령대에 비해 유의하게 높은 비율을 보여주었다[22]. 결국 30세 이하 환자의 불량한 예후의 원인은 지연된 진단, 불량한 조직학적 특징으로 인한 것일 가능성이 크다.
이번 연구에서 유전성 대장암의 범주에 해당되는 환자군은 제외하고 분석하였지만, 이에 해당되지 않는 가족력을 가진 군은 포함시켜서 연구가 진행되었다. 본 연구의 30세 이하 환자들에서 1도 가족력이 있는 경우는 7.6%로, 본원의 전체 대장암 환자 15,206명 데이터에서 가족력이 있는 경우 6.5% (본문에서 자료는 제시되지 않음)와 큰 차이는 없었다. 즉 유전성 대장암을 제외하면 가족력을 가진 대장암의 비율은 30대 이전과 30대 이전의 환자와 아주 큰 차이를 보이지 않았다. 그러나 MSI-H를 나타내는 환자는 30세 이하 환자 79명 중 10명으로 12.7%를 보였다. 이는 본원에서 수술을 받은 타 연령층에서 보이는 MSI-H 비율에 비해 상당히 높은 것으로 분석되었다(본문에서 자료는 제시되지 않음). 또 이러한 MSI-H에 관련되는 유전자는 주로 MLH1일 가능성이 매우 높아서 70% 가까운 경우 단백의 소실이 있었다. 이에 비해 MSH2 단백의 소실은 11%의 환자에서만 발견되었다. 현미부수체 불안정성 결과 및 면역화학염색검사를 종합하면, 30대 이하 젊은 환자군에서 산발성 대장암으로 분류된 환자들 중 가족력이 충분히 발현되지 않은 유전성 대장암의 가능성이 있는 경우도 있겠지만, 다른 기전으로 현미부수체 불안정성을 보일 수 있는 MLH1 촉진자메칠화 역시 젊은 연령층의 현미부수체 불안정성의 원인이 될 수 있을 가능성을 완전히 배제하기 어렵다. MSI-H 환자를 제외한 87.3%의 30대 이전에 발생한 대장암 환자들의 경우 대장암 발생이 유전적 요인이라고 해석하기 어렵다. 따라서 향후 순수한 산발성 대장암이 아주 젊은 연령층에 나타나는 기전에 대한 연구가 필요할 것이다.
나이와 생존율 사이의 관계는 여전히 논란이 있다. 몇몇 연구에서는 청년층이 노년층에 비해 나쁜 예후를 보이는 것으로 보고하였고[5,6], 연령과 예후와는 관계가 없다는 반대의 결과를 보고한 연구들도 있다[9,23]. Kim 등[24]이 45세 이하 환자 693명과 56세 이상 환자 1,823명을 비교 연구한 결과에서 45세 이하 5년 생존율은 81.2%이었고, Stage I에서 98.1%, Stage II에서 93.7%, Stage III에서 78.2%, Stage IV 에서 39.0%로 보고되었다. 본 연구에서는 30세 이하 환자의 전체 생존율은 72.8%, Stage I에서 100%, Stage II 100%, Stage III 75.9%, Stage IV 31.4% 로 전체 생존율과 진행된 병기(Stage III+IV)에서 생존율이 더 불량하게 나타났다. 반면 병기별 생존율을 보면 1기, 2기에 경우 비교적 우수한 생존율을 보여주고 있어서, 젊은 환자에서도 대장암 선별 검사로 조기 발견을 할 수 있다면 생존율의 개선을 기대할 수 있을 것으로 보인다. 그러나 어떤 기준에 따라 30대 이하에게 선별검사를 권유할 것인지에 대해서는 향후 논의가 필요할 것이다.
청년층 대장암 환자들은 진단 당시 원격 전이가 있는 경우나 수술 후 재발률도 높다[24]. 본 연구에서 진단 당시 원격 전이가 있던 경우는 총 24예(30.4%)였고, 근치적 목적으로 R0 절제를 시행한 환자 52명 중 수술 후 재발이 있었던 환자는 총 12예(23.0%)였다. 결국 30대 이하의 대장암은 전체적인 예후가 나쁘다고 분석할 수 있으며 기존의 보고와 비교할 때 40대 혹은 50대 이하로 분류된 대장암보다 더 나쁜 예후를 보일 가능성도 크다. 이러한 예후는 단지 진단되었을 당시 높은 병기 즉 늦은 발견에 기인한 것인지, 근본적으로 공격적인 성향의 대장암 발생이 높은 것에 기인한 것인지 구별하기 어렵지만 본 연구의 분석을 보면 이러한 요인이 모두 종합적으로 작용하였을 가능성이 크다.
본 연구는 비교적 충분한 수의 30대에서 발생한 산발성 대장암 환자를 분석한 것에 의의가 있지만 대조군에 대한 연구가 없고, 유전 자 변이 검사가 누락된 예가 많으므로 이에 대한 추가의 연구가 필요할 것이다. 하지만 30대 이하의 대장암의 경우도 대부분 산발성으로 발생하며 이 경우 나쁜 예후를 보이는 것으로, 향후 가족력이 전혀 없는 젊은 연령층의 대장암을 빠르게 진단하기 위한 방책을 고안할 것을 제안한다.
CONFLICT OF INTEREST
No potential conflict of interest relevant to this article was reported.