대장암 조직에서 Securin의 발현과 임상적 의의
Expression and clinical significance of the securin in colorectal cancer
Article information
Trans Abstract
Purpose:
Securin is a regulatory protein, which plays a central role in chromosome stability and control of the metaphase-anaphase transition and anaphase onset. Securin blocks separase/extra spindle pole bodies homolog 1 function, preventing the proteolysis of the subsequent dissociation of the chromosome. Securin is expressed at low level in most tissues, but many patient suffering epithelial neoplasms are over-expressed. The aim our study was to evaluate whether securin affects tumorigenesis and prognosis in patients of colorectal cancer.
Methods:
To clarify the roles of securin in colorectal tumorigenesis, its expression was examined by immunohistochemistry on a tissue microarray with its comparison with clinicopathologic parameters and prognosis survivals of the colorectal carcinomas.
Results:
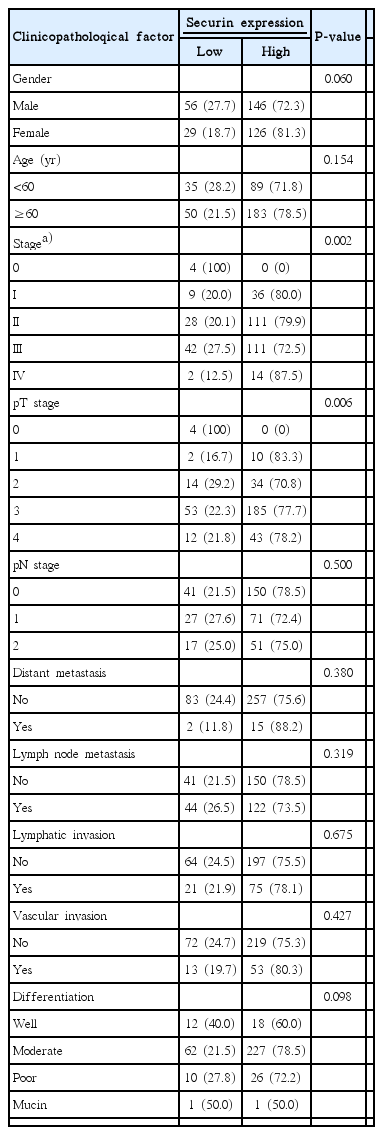
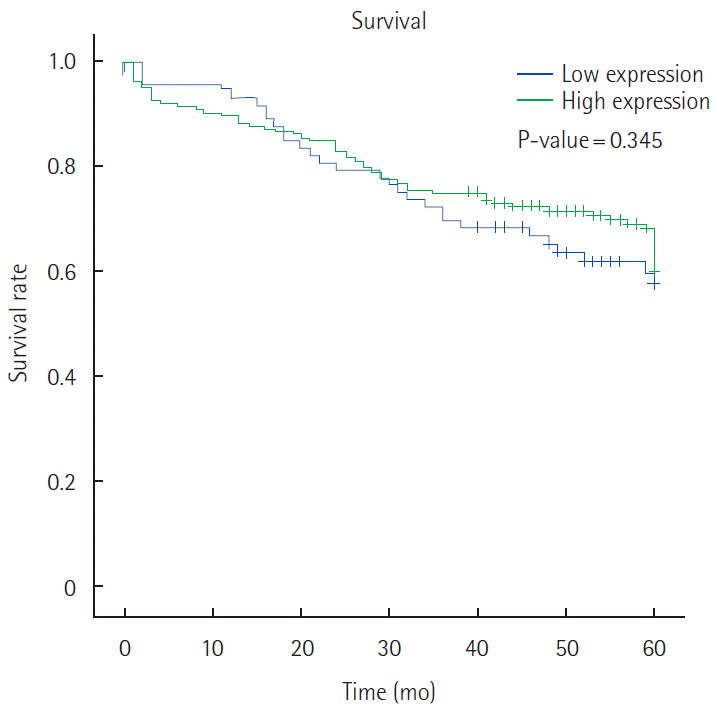
Securin was overexpressedin 272 (76.2%) of 357 colorectal carcinomas. Overexpression of securin was correlated with gender (P=0.060), pathologic T stage (P=0.006) and tumor node metastasis stage (P=0.002), but securin overexpression was not correlated with lymphovascular invasions. Securin overexpression was not correlated with 5-year survival rate by Kaplan-Miere survival model.
Conclusion:
Securin expression was correlated with T stage and TNM (tumor node and metastasis) stage in colorectal cancer. Our study showed a possible role for securin in colorectal tumorigenesis. These findings indicate that securin has a function of tumorigenesis with tumor enlargement, not of lymphovasculogenesis.
서 론
대장암은 전세계적으로 발생률과 사망률이 높은 악성 종양으로, 최근 대한민국에서 대장암의 발생률과 사망률도 높아지고 있다[1]. 이에 따라 대장암에 대한 많은 연구가 이루어지고 있으며 이러한 노력으로 다양한 항암제의 개발과 수술 술기의 발달이 이루어져 치료 효과는 높아지고 있지만, 대장암으로 인한 사망률은 여전히 높은 실정이다.
최근 종양 연구에 있어서 종양 주변의 미세환경과 유전자에 대한 연구가 많이 이뤄지고 있으며, 다양한 연구들에 따르면, 암 발생의 원인과 예후에는 다양한 유전자가 관련되어 있는 것으로 알려져 있다.
Securin은 정상적으로 세포의 분열에 중요한 기능을 가지는 단백질이지만, 이 단백질의 과발현이 세포 분열에 비정상적인 영향을 주는 가능성은 다양하게 제시되어 왔다. 세포 분열 시 발생하는 염색체 이상은 많은 교정의 기전이 있음에도 불구하고, 부분적인 홀배수체(aneuploidy) 세포가 발생하고, 이렇게 발생한 홀배수체는 다양한 악성 종양과 관련성을 보인다[2].
이에 본 연구에서는 딸염색체 분열에 영향을 미쳐, 홀배수체 형성 등 유전적 불안정성을 갖게 만들 수 있는 인자인 securin의 발현과 대장암 환자의 임상병리학적 인자들을 연구하여 securin이 대장암의 암 발생 과정 및 대장암 환자의 예후에 영향을 미치는지 여부를 알아보고자 하였다.
방 법
순천향대학교 천안병원에서 2005년 1월부터 2010년 12월까지 대장암으로 수술을 시행한 357명의 환자를 대상으로 하였다. 환자의 나이, 성별, 병리학적 소견을 검토하였으며 종양의 병기는 American Joint Committee on Cancer 7판을 기준으로 분류하였다.
외과적으로 절제된 대장암조직의 대표적인 종양 부위에서 파라핀 포매(embedding)에 의해 조직 미세배열(tissue microarray) 블록 절편을 만들어 면역조직화학 염색(anti-securin antibody [DCS-280], Abcam plc, Cambridge, UK)을 시행하였다. 면역조직화학염색의 결과는 정상 대조염색이 되었던 종양세포에 비해 securin이 강하게 (++, +++) 발현된 경우를 고발현군, 약하게(+, –) 발현된 경우를 저발현군으로 나누어 판단하였다.
통계검증은 SPSS ver. 14.0K (SPSS Inc., Chicago, IL, USA)을 이용하여 securin 저발현군과 고발현군의 임상병리학적 변수들을 Pearson’s chi-square test를 이용하여 비교하였다. 대상 환자의 추적은 후향적으로 의무기록과 전화추적을 통해 시행하였으며 저발현군과 고발현군과의 5년 생존율을 Kaplan-Meier 법을 이용하여 비교하였으며, 357명의 환자 중 5년 추적이 가능한 2007년 이전 환자인 179명을 대상으로 평가하였다. 모든 결과는 P<0.05일 때 통계학적으로 유의한 것으로 정의하였다.
본 연구는 순천향대학교 임상윤리심의위원회의 승인을 받아 시행하였다.
결 과
면역조직화학 염색 결과
대부분의 정상 대장점막세포에서는 securin발현이 관찰되지 않았고(Fig. 1 A), 종양에 따라 염색 정도의 차이를 보였다(Fig. 1 B-D). 정상세포와 악성 세포가 같이 있는 부위에서 악성 종양에서만 securin이 발현되는 모습을 보이기도 하였다(Fig. 2). Securin의 발현은 핵과 세포질에서 모두 발현되는 양상을 보였으며, 세포질에서도 좀 더 강하게 염색되는 경향을 보였다.
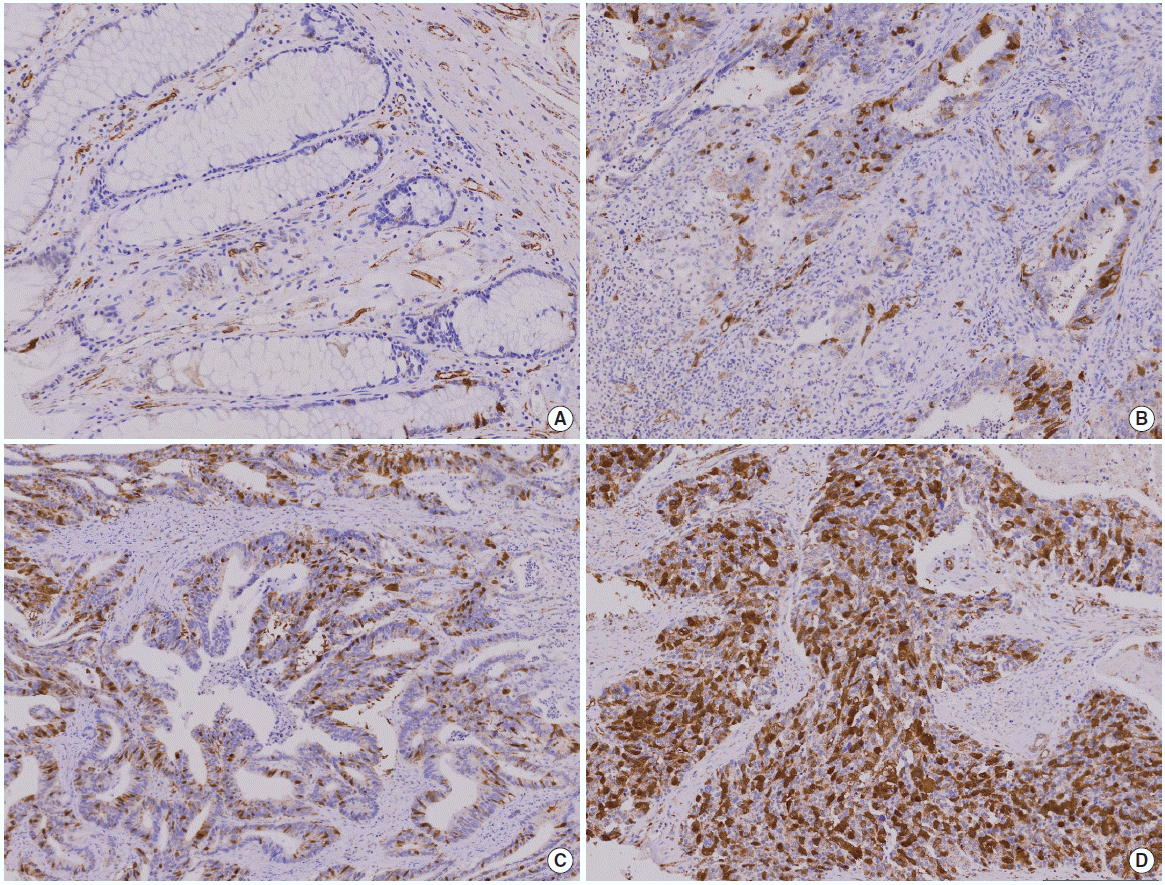
Immunohistochemical stain of securin expression (securin immunostain, ×200). (A) Normal tissue. (B) Mild expression of securin. (C) Moderate expression of securin. (D) High expression of securin.
임상병리학적 인자와의 관련성
총 357명의 대상 환자 중, 대장암 조직에서 securin의 발현이 고발현으로 나타난 것은 272명(76.2%)이었으며, 저발현으로 나타난 환자는 85명(23.8%)이었다(Table 1). 그 중 남자는 202명, 여자는 155명이었으며, 연령별로는 60세 이상이 233명, 60세 미만이 124명이었다(Table 2).
대상 환자 중 상피내종양(Tis)는 4명으로 모두 securin 저발현이었고, T1 12명 중 10명(83.3%), T2 48명 중 34명(70.8%), T3 238명 중 185명(77.7%), T4 55명 중 43명(78.2%)에서 securin의 발현이 고발현으로 나타났다. T병기와의 관련성에서 securin 발현은 T 병기와 유의한 상관관계를 보였다(P=0.006). N병기와 securin 발현과의 관계에서는 유의한 상관관계를 보이지 않았으며 원격전이 유무에 따른 구분에서도 securin의 발현과 상관관계를 보이지 않았다.
림프절 전이가 있는 환자166명 중 122명(73.5%)에서 securin의 과발현이 나타나는 경향을 보였으나, 통계적으로 유의한 상관관계는 없었다(P=0.319). 그 외 종양 세포의 림프침습, 혈관침습, 암 세포의 분화도와 securin의 발현과는 관련성을 보이지 않았다.
Securin 고발현군과 저발현군과의 5년 생존율을 Kaplan-Meier 법을 이용하여 비교하였으나, 두 군 사이의 예후에 유의한 차이는 보이지 않았다(Fig. 3).
고 찰
대장암에 대한 연구로 종양억제유전자인 p53을 비롯하여 다양한 유전자가 대장암의 발생을 억제하는 것이 알려졌고, 그 외에도 1993년에 Thibodeau 등[3]이 유전성비폴립대장암(hereditary nonpolyposis colorectal cancer) 환자에서 현미부수체불안정성(microsatellite instability, MSI)를 발견하고 그 관련성을 알아냄으로써, 대장암에서 유전자의 문제 등이 종양 생물학적으로 중요한 부분을 차지함이 알려지고 대장암에 대한 새로운 관점으로 자리 잡았다.
대장암의 발생 과정은 정상점막세포에서 선종(adenoma)을 거쳐 악성 종양으로 진행되며, 이를 선종-암종연쇄(adenoma-carcinoma sequence)라고 한다[4]. 이 과정이 이루어지기 위해서 genomic instability를 포함한 수많은 유전자의 변화가 필요하다. Genomic instability의 명백한 경로 최소 3가지는, 염색체 불안정성(chromosomal instability, CIN), MSI, CpG island methylator phenotype (CIMP)이다.
CIN은 산발성 대장암의 65%–70%에서 나타나며, CIN의 결과로 홀배수체, 아염색사상 유전자 증폭(subchromosomal genomic amplification)등이 발생한다. 이는 많은 유전자의 손실 혹은 변이를 일으켜 핵형의 변화 등을 유도하며, 세포의 생존에 직접적으로 영향을 준다[5]. Adenomatous polyposis coli 유전자는 산발성 대장암의 약 74%에서 돌연변이가 나타나며, 이 유전자는 초기 대장암의 발생에 중요한 역할을 한다[6]. p53의 점변이나 deleted in colorectal carcinoma의 억제도 대장암에서 흔히 발견된다[6,7]. 이와 같은 다양한 유전자가 대장암의 발생에 관련된 것이 알려지고 있으며, 추가적인 연구들로 유전자의 변이뿐만 아니라 DNA 불일치복구시스템(mismatch repair system)의 손실에 의한 MSI가 대장암의 발생과 예후에 영향을 미치는 것을 알게 되었다[8]. CIN과 MSI 모두 예후에 영향을 미치나 동시에 발현되는 것은 아니며, MSI 대장암의 25%에서 CIN이 동반되고, CIN대장암의 12%가 높은 MSI를 보였다[9].
홀배수체는 대표적인 유전자의 불안정한 면 중의 하나이다[10]. Boveri [11]는 100여년 전에, 세포 분열 시 유사분열방추장치(mitotic spindle apparatus)의 이상에 의한 비정상적인 세포 분열이 세포의 홀배수체 등을 만들고 이런 비정상적인 유전적 상태가 암을 유발할 것이라고 추측했다. 그 이후, 많은 연구에 의해 세포분화주기의 여러 검문(check point)의 이상으로 방추체(spindle)구조나 자매염색분체(sister chromatid)의 분열에 장애가 생겨 유사분열(mitosis)이 비정상적으로 일어남으로써 세포의 홀배수체가 나타나고[12], 그 결과 악성화가 진행된다는 것을 알게 되었다.
세포분열의 과정은 염색체형태의 변화와 이동에서 매우 역동적인 변화과정을 거친다. 유사분열의 단계를 명확하게 구분할 수는 없지만, 크게 전기(prophase), 전중기(prometaphase), 중기(metaphase), 후기(anaphase), 말기(teleophase)의 다섯 과정으로 나눈다[13]. 유사 분열은 전기 중 응축된 염색체가 보일 때 시작되어, 전기가 끝날 무렵 핵막이 파괴되면서 전중기가 시작된다. 분열되는 딸염색체의 동원체(centromere)에는 단백질-DNA구조인 동원체(kinetochore)와 중심소체(centriole)로 구성된 세포중심(centrosome)이 있는데, 여기에 미세관(microtubule)이 붙게 된다[14]. 이 미세관에 의해 각각의 딸염색체가 세포분열의 양극간으로 이동하게 되는 중기로 진행된다. 중기가 진행되는 동안 딸염색체는 미성숙 분열이 될 수 있는 위험이 있다. 그래서 중기 동안 spindle assembly checkpoint (SAC)가 활성화되어 딸염색체의 미성숙분열이 이루어지지 않도록 한다. 모든 딸염색체가 1:1로 핵의 중심에 정렬이 되고, 각각의 동원체가 방추체에 붙으면, SAC는 그 역할을 완수하여 다음으로 진행된다. 결과적으로 SAC에서 anaphase-promoting complex (APC)에 의해 Cyclin B와 securin 등이 활성화 되어 중기의 진행이 결정된다. APC와 Cdc20의 결합체에 의해 securin은 탈인산화(dephosphylation)되어 securin-Separase 결합체에서 분리되며, separase가 활성화 된다. 활성화된 separase는 자매염색분체를 잡고 있는 cohesin을 잘라내어 말기를 시작한다[15].
세포분열기 사이에 유사분열과정이 실패할 경우, 세포 분열이 정지가 되거나 세포자멸사(apoptotic cell death)가 p53의 조절하에 진행되지만[16,17], 세포분열에 문제가 발생하여 이배수체(diploid)나홀배수체가 되어도 다음 분열기로 넘어가는 경우도 많다. 하지만, 이러한 경우에도 결국엔 세포의 자멸사를 유도하는데, 이는 p53 이외의 경로가 세포자멸사를 유도하여 교정하는 것을 뜻한다[18].
홀배수체는, 주로 중기에서 말기로 넘어가는 과정에서 발생하는 문제들에 의해서 생긴다. 방추체, 염색분체(chromatid)의 형성 및 정상적인 기능, cohesin을 잘라 양극간으로 자매염색분체를 옮기는 역할을 하는 separase의 활성 등에 이상이 발생하면 홀배수체가 생긴다. 자매염색분체를 나누는 sepase는 securin와 결합되어 있는 상태로 존재하다가 APC/C가 활성화 되어 separase와 securin을 분리시켜 separase가 codhesin을 잘라 말기를 진행시킨다. 이 과정에서의 오류는 균등하지 못한 딸염색체의 배분으로 이어지며 홀배수체를 형성한다.
Securin은 rat pituitary tumor에서 발견된 단백질이다. Pituitary tumor transforming gene (PTTG)에서 발현되어 유사분열 시기 중 APC와 관련하여 anaphase inhibitor 의 역할을 하여 염색분체 분리에 관여한다[19,20]. 일반적인 상태에서 securin은 염색체의 비정상적인 분리를 막아주며, 유전적 안정성을 갖게 한다[21]. 또한 securin은 불안정한 염색체 분리를 막아서 DNA 손상 교정을 할 수 있도록 하고, DNA나 방추체의 손상에 의한 염색체의 분리가 비정상적일 때 진행을 억제하여 홀배수체 등의 발생을 막는다[22,23].
Securin은 정상세포에서는 낮은 발현을 보이지만, 사람의 뇌하수체 종양[24]과 갑상선암[25] 및 대장암[26], 유방암[27] 및 다양한 악성 종양에서 높은 발현을 보였다[19,28]. 또한, 암세포의 분화와 종양형성을 유도하는 것을 확인하였으며[19,29], 또 다른 연구에서는 securin이 종양의 침습 정도와 전이와의 관련성을 보였다[30].
Securin의 과도한 발현은 separase와 결합이 증가하거나, 유리 separase형성을 방해하여 정상적인 핵분열을 막을 수 있다. 결과적으로 CIN의 증가와 악성화를 더욱 유도할 가능성이 높으며, 다양한 암종에서 securin의 과발현이 확인되었다[26-28]. 본 연구의 결과에서는 모든 대장암에서 securin의 발현이 증가한 것은 아니었으나, 대장암의 침습 정도가 securin의 발현과 관련성이 있음을 보여 주었다. Boelaert 등[30]에 의하면, securin의 발현이 종양의 분화도, 전이성과 연관이 있는 것으로 나타났지만, 본 연구에서는 관련성을 찾을 수 없었다. 그와 더불어 securin의 발현과 대장암 환자의 예후와의 관련성도 찾을 수 없었다.
지금까지의 연구에서 separase의 조절자로 알려져 있는 securin은 separase의 활성을 조절하는데 있어서 매우 제한된 역할을 하는 것으로 최근에 다수 보고되어 있고, 이들 securin/PTTG1 유전자를 knock-out 또는 knock-down 시켰을 때 세포 내의 염색체의 비정상적인 분리나 염색체의 불안정이 거의 관찰되지 않는 것으로 알려져있다. 이는 securin/PTTG1이 separase의 기능조절에 충분치 않음을 명확하게 나타낸 것으로, 최근들어 separase의 기능을 통제하는 조절자가 무엇인지, 그리고 cohesin complex의 분해를 통제하는 separase이외의 또 다른 조절 인자는 무엇인지에 대한 연구가 세포내의 염색체의 안정성과 유사분열 세포주기를 조절하는 데에 있어서 매우 중요한 의문으로 부각되고 있다.
본 연구에서는 securin의 발현은 핵뿐 아니라, 세포질에서도 강하게 나타나는 것을 확인하였다(Fig. 4). Securin은 separase와 복합체로 존재하다 후기에서만 분리되어 기능을 하므로, 세포질과 핵 중 어떤 것에서 발현되는 것이 그 기능과 관련이 있는지는 불명확하며, 면역화학염색에 의한 단백질의 발현 정도로써 securin의 기능과의 관련성을 단정짓기는 어렵다. 따라서 securin의 기능 발현에 대한 연구로 면역화학염색 방법 외에 PTTG의 mRNA를 직접 확인하는 것이 보다 명확히 securin의 기전을 이해하는 데 도움이 될 것으로 생각된다. Securin의 과발현은 세포분열을 비정상적으로 유도함으로써 악성화를 일으키지만, 반면에 세포분열의 종결을 일으켜 p53에 의한 세포자멸사를 유도하기도 한다. 이러한 점을 고려하여 securin의 발현과 기전에 대한 추가적인 연구가 진행된다면, 새로운 표적치료의 방향을 제시할 수 있을 것이라 생각된다.
본 연구의 결과로서 securin은 대장암 세포의 세포질에서 정상세포보다 더 강하게 발현되는 경향을 보이는 것으로 나타났다. 또한 대장암의 발생기전 중 CIN에 관여하는 securin은 대장암의 침습 정도와 관련이 있는 것을 확인할 수 있었다. 하지만 관련이 있을 것으로 기대되었던 림프관 침습이나 혈관 침습 등과는 관련이 없는 것으로 나타났으며 환자의 예후와도 직접적인 연관관계는 보이지 않았다. 추후 securin에 대한 분자생물학적 연구가 추가적으로 진행된다면 대장암에서 securin의 역할에 대한 보다 정확한 규명이 가능할 것으로 생각된다.
Notes
No potential conflict of interest relevant to this article was reported.