ABSTRACTPurpose:Pancreatic neuroendocrine tumors (PNETs) are rare neoplasms with reported incidence of < 1 per 100,000 persons per year. PNETs are classified as functional or nonfunctional depending on their production of specific pancreatic endocrine hormones. This study presents the clinicopathologic characteristics and outcomes of PNETs experienced in a single institution.
Methods:Between 1995 and 2011, clinicopathological data of 116 patients with PNETs proven by surgical pathology were reviewed retrospectively.
Results:Of the 116 patients, mean age was 58.0-year-old. Median follow up was 60.1 months. Curative resection was achieved in 110 patients, and 24 patients (20.7%) had recurrence, which was most common in liver. The overall 5-year survival rate was 96.8%. Both the American Joint Committee on Cancer (AJCC) seventh staging (P=0.031) and World Health Organization (WHO) classification (2010) (P=0.011) correlated with prognosis. Functioning PNETs patients were younger than non-functioning PNETs patients at the time of diagnosis (P=0.008). Functioning PNETs had earlier T stage (P=0.001), AJCC seventh staging (P=0.001), and WHO classification (2010) (P=0.015) then non-functioning PNETs. By multivariate analysis, perineural invasion (odds ratio [OR], 10.151; 95% confidence interval [CI], 1.582— 65.147, P=0.015) and lymphovascular invasion (OR, 5.119; 95% CI, 1.642—15.956; P=0.005) were poor prognostic factors.
서 론췌장 신경내분비 종양은 최근 발생 및 진단 빈도가 높아진 것으로 보고되고 있으나[1,2] 전체 유병률이 10만명 당 1명 이하의 드문 질환으로 임상양상 및 생존과 관련된 예후 인자는 정확히 알려져 있지 않다[3,4]. 지금까지의 국내외 보고들은 대부분 그 증례가 부족하여 일반화된 결론을 내리기에는 어려움이 있었다[5-7].
췌장 신경내분비 종양은 임상양상에 따라 기능성과 비기능성 신경내분비 종양으로 분류할 수 있는데, 현미경적으로는 감별이 어렵고 종양자체에서 분비하는 활성 신경내분비 호르몬과 연관된 임상증상의 발현여부를 바탕으로 분류한다[8]. 기능성 신경내분비 종양은 종양에서 분비하는 신경내분비 호르몬과 연관된 임상증상이 나타나는 것으로 알려져 있으나 실제 임상에서는 그러한 증상을 호소하더라도 질환의 희귀성 때문에 의심하여 진단하기가 쉽지 않고, 비기능성 신경내분비 종양은 호르몬의 과다 분비와 관련된 임상 증상이 없고 임상병리학적 혈액검사로 진단할 수 있는 방법이 없기 때문에 진단과 적절한 치료가 지연되는 경우가 많다.
췌장의 신경내분비 종양 중 주변 조직으로의 침습이나 원격 전이가 있는 고악성도 종양의 빈도가 기능성 신경내분비 종양의 경우 인슐린종은 10%, 가스트린종은 60%, 비기능성 신경내분비 종양은 50%–90% 정도로 알려져 있고[9,10], 악성화가 진행된 경우 대부분 간부전으로 사망하게 되나 성장 속도가 늦어 췌장선암에 비해서는 예후가 양호한 것으로 보고되고 있다[11,12]. 그리고 기능성 종양이 비기능성 종양에 비해 좋은 예후를 보인다고 알려져 있으나[3], 이와는 반대로 기능성 종양과 비기능성 종양의 예후에 유의한 차이가 없다고 밝힌 연구들도 있다[13-15].
췌장 신경내분비 종양의 병기 분류는 크게 AJCC 7판 분류 및 World Health Organization (WHO) 분류로 나뉘어진다. American Joint Committee on Cancer (AJCC) 7판에서는 6판까지 별도의 분류가 없었던 췌장 신경내분비 종양의 병기가 도입되었으나 기존 췌장암의 분류방법을 적용하였다. 2010년에 개정된 WHO 분류는 2005년 유럽 신경내분비 종양 학회에서 제시되었던 핵감수분열 및 Ki-67 지수를 반영하여 종양을 3개의 등급으로 나누었으나[16] 이전 분류 기준에 포함되어있던 종양의 크기가 제외되었고 그 임상적 가치는 아직 충분히 밝혀지지 않은 상태이다.
이에 본 연구에서는 췌장 신경내분비 종양의 기능 여부에 따른 임상병리학적 특징 및 수술적 치료 이후의 장기생존결과와 예후인자를 알아보고, 췌장 신경내분비 종양의 분류 기준인 AJCC 7판과 WHO 분류 방법에 따른 예후 예측 능력도 비교해보고자 하였다.
방 법췌장 신경내분비 종양은 다양한 호르몬들을 분비하며 호르몬과 관련된 임상적 증상의 유무에 따라 기능성과 비기능성 종양으로 구분된다. 인슐린종은 Whipple’s triad로 특징되는 저혈당에 의한 증상이 관찰되고 글루카곤종은 당뇨, 피부염, 심부정맥혈전증, 우울증, 체중감소가 동반될 수 있고, 소마토스타틴종은 대부분 무증상이나 지방변, 당뇨, 흡수장애가 나타날 수 있으며 담낭결석이 동반되는 경우도 있다. 이런 임상 증상과 함께 면역병리조직검사에서 해당 호르몬이 확인되면 기능성 종양으로 진단하며, 호르몬의 과다분비가 있으나 그로 인한 증상이 없는 경우 비기능성 종양으로 진단할 수 있다[17].
본 연구에서는 1995년 12월부터 2011년 11월까지 서울대학교병원에서 조직학적으로 확진된 116명의 췌장 신경내분비 종양 환자의 의무기록을 후향적으로 조사하였다. 대상 환자들의 나이 및 성별, 진단 시 임상 증상을 비롯하여 종양의 위치, 크기, 림프절 및 간전이 유무를 AJCC 7판 병기[18] 및 WHO 분류(2010) [19]에 따라 비교 분석하였고 수술 후 재발 여부 및 치료 결과를 포함한 장기생존결과를 조사하였다.
수술 전 영상학적 검사로는 대부분의 환자에서 복부 computed tomography 또는 복부 magnetic resonance imaging을 시행하였고, 일부에서는 복부 초음파를 시행하였다. 영상 소견에서 췌관의 지름이 5 mm 이상인 경우 췌관의 확장이 있는 것으로 정의하였고, 담관의 확장은 7 mm를 기준으로 판단하였다[20,21].
SPSS ver. 19.0 (IBM, Armonk, NY, USA) 프로그램을 사용하여 연속변수는 Student’s t-test, 이항 변수는 chi-square test 및 Fisher’s exact test, 다변량 변수는 binary logistic regression model, 생존그래프는 Kaplan-Meier법을 통해 분석하였다. P값이 0.05 미만인 경우 통계적으로 유의한 것으로 판정하였다.
결 과임상상 및 영상 소견대상 환자의 평균 연령은 58.0± 16.2세(범위, 9–87세)였고 남녀 비는 1:0.9였으며 중앙 추적관찰기간은 48.5개월(범위, 0.1–206.2개월)이었다. 진단 당시 증상은 무증상인 경우가 53명(45.7%)으로 가장 많았고 다음으로 복통(n= 24, 20.7%), 체중 감소(n=9, 7.8%) 등이 있었다. 종양은 두부에 위치한 경우가 58예(50.0%)로 가장 많았고, 체부 및 미부에 51예(44.0%), 췌장 전반에 걸친 다발성 종양이 3예(2.6%)있었다. 수술적 치료는 췌미부절제술 50예(43.1%)로 가장 많았고 췌십이지장절제술 48예(41.4%), 종양핵적출술 12예(10.3%), 췌전절제술이 4예(3.4%) 시행되었다.
수술 전 고악성도 종양으로 진단된 경우는 12예였는데, 이는 간 전이가 있었거나(n=5), 췌장 주변조직 침범 소견(n=8)을 보였기 때문이었으며 1명의 환자는 이상의 두 가지 소견을 모두 갖고 있었다. 근치적 의도의 절제는 112예(96.5%)에서 이루어졌으며 이 중 2예(1.7%)는 수술 후 병리검사 결과 절제연 양성으로 드러났다. 이 외에 다발성 간 전이가 있어 종양을 남겨둔 고식적 절제가 이루어진 경우가 2예(1.7%) 있었다(Table 1). 그 중 1예는 췌십이지장절제술 및 S5, S8의 전이 소견에 대해 종괴절제술을 시행하였고 육안적으로 절제연 양성소견이었으나 추가적인 간절제를 시행하지는 않았으며, 다른 1예는 수술 중 초음파에서 우간의 3개 이상의 다발성 전이성 병변이 추가 확인되어 췌미부절제술 및 고식적 S3 종괴절제술을 시행하였다.
기능성 종양 환자와 비기능성 종양 환자의 두 군으로 나누어 비교하였을 때, 진단 시 연령이 기능성 종양에서 더 젊었으나, 성별, 진단시 증상, 종양의 위치 및 R0 절제율은 두 군 간에 유의한 차이가 없었다. 그 중 진단 시 증상은 기능성 종양 25예에서 복부 통증 2예(8.0%), 체중 감소 3예(12.0%), 저혈당에 의한 증상 20예(80.0%)가 나타났고, 비기능성 종양 91예 중에서는 52예(57.1%)가 무증상으로 가장 많았으며 비특이적인 상복부 복통이 22예(24.2%) 확인되었다. 수술 전 영상학적 검사 결과 종양으로 인한 원위부 췌관의 확장 소견, 담관의 확장 소견, 동맥기에서 종양의 강한 조영 증강 소견, 종양 중심부 괴사 소견, 췌장주위조직 침습 소견은 기능성과 비기능성 종양 간 유의한 차이가 관찰되지 않았다(Table 1).
병리 소견병리학적 소견에서 췌장막 침범이 있는 경우가 31예(26.7%), 림프절 전이는 13예(11.2%) 있었고 간으로의 원격전이는 5예(4.3%)에서 관찰되었다. 21예(18.1%)에서 현미경적 주위 신경조직 침범, 36예(31.0%)에서 현미경적 림프관 또는 미세혈관침윤이 관찰되었다. AJCC 7판을 기준으로 한 조직학적 병기[18]는 1기 73예(69.5%), 2기 27예(25.7%), 3기 0예(0%) 및 4기 5예(4.8%)로 분류되었다. WHO 분류 (2010) [19]를 기준으로 하였을 때에는 G1이 75예(67.6%), G2가 31예(27.9%), G3는 5예(4.5%)로 나타났다.
기능성 종양의 경우 분비되는 활성 신경내분비 호르몬과 그에 연관된 임상증상의 발현여부에 따라 인슐린종, 가스트린종, 소마토스타틴종, 글루카곤종, VIPoma 등으로 나누어진다. 본 연구에서는 기능성 종양 중 인슐린종이 16예(64%)로 가장 많았고, 복합형 5예(20%), 소마토스타틴종 3예(12%), 글루카곤종이 1예(4%) 있었다. 기능성 종양과 비기능성 종양 두 군 사이에 종양의 평균 크기는 유의한 차이가 없었으나(P=0.168), 기능성 종양은 2 cm 이하의 크기를 갖는 종양의 빈도가 높았다(P<0.001). 기능성 종양은 비기능성 종양과 비교하여 낮은 T병기(P=0.001), AJCC 7판 병기(P=0.001) 및 WHO 등급(2010) (P=0.015)을 가지고 있었다. 병리학적 소견에서 두 군 간 림프절 전이, 현미경적 주위 신경조직 침범, 현미경적 림프관 또는 미세혈관침윤, 간 전이의 유의한 차이는 확인되지 않았다(Table 2).
재발 및 장기 생존 결과근치적 의도의 절제가 이루어진 112명 중 23명(20.5%)의 환자가 재발하였는데 이 중 간 전이 18예(16.1%), 복강내 림프절 전이 4예(3.6%), 잔존 췌장 전이 1예(0.9%)가 있었다.
WHO 분류(2010)에 따른 재발양상을 살펴보면 G1은 75예에서 9예의 재발이 관찰되었고 그 중 8예는 간 전이, 1예는 쇄골위 림프절 전이로 나타났다. 재발된 9예 중에서 사망한 예는 2예로, 원인은 간 농양에 의한 패혈증 1예와 주폐포자충 폐렴으로 인한 호흡부전 1예로 보고되었고, 재발이 없었던 66예 중에서는 수술 후 출혈로 인한 사망 1예 외에 사망한 예는 확인되지 않았다. G2 31예 중 근치적 의도의 절제가 30예에서 이루어졌고 재발은 11예 있었으며 7예는 간 전이, 3예는 복강내 림프절 전이, 1예는 잔존 췌장 전이의 형태로 나타났고 추적관찰기간 중 사망 예는 3예 확인되었다. 사망 원인 중 1예는 패혈증, 1예는 다발성 간 전이에 의한 간부전이었으며 췌십이지장절제술 및 S5, S8의 전이 소견에 대해 종괴절제술을 시행하였고 육안적으로 절제연 양성 소견이었으나 추가적인 간절제를 시행하지는 않았던 1예에서는 다발성 간 전이가 발생한 이후 다발성장기부전으로 사망하였다. G3는 근치적 의도의 절제가 이루어진 4예 중 3예에서 재발하였는데 모두 간 전이로 나타났고 재발된 예에서는 추적관찰 기간 중에 사망 예는 확인되지 않았다. 재발이 확인되지 않았던 1예는 추적관찰 기간 중 패혈증으로 사망하였고 고식적 절제가 시행되었던 1예는 심부전 및 폐색전증으로 사망하였다(Fig. 1).
췌장 신경내분비 종양 환자 전체의 5년 생존율은 96.7%였다(Fig.2A). 기능성 종양의 5년 생존율은 100%, 비기능성 종양의 5년 생존율은 96.0%였으며 두 군 간 유의한 차이는 없었다(P=0.579) (Fig.2B). AJCC 7판 병기별 5년 생존율은 1기에서 98.6%, 2기에서 93.3%, 4기에서 66.7%였고(P= 0.017) (Fig. 3A), WHO 분류에 따른 5년 생존율은 G1에서 98.7%, G2에서 94.4%, G3에서 66.7%였다(P=0.001)(Fig. 3B). 5년 무병생존율은 78.6%였다(Fig. 4). 재발한 24명의 재발이후 중앙 생존기간은 27.2개월(범위, 0–159.1개월)이었고 재발 이후 3년 및 5년 생존율은 각각 86.3%, 77.6%였다(Fig. 5). 재발에 대한 치료로 항암요법(n= 5), 고주파 치료(n= 7), 간동맥 색전술(n= 8), 재수술(n= 6) 등이 단독 또는 병행 사용되었다(Table 3).
예후인자 및 병기 분류 방법에 따른 예후 예측 능력WHO 분류에 따라 G1과 G2 및 G3 환자군의 수술 전 임상적 특징을 비교 분석하였을 때 연령, 성별, 진단 시 증상 및 종양의 위치에 따른 유의한 차이는 관찰되지 않았으나 G1에서 G2 및 G3에 비해 동맥기에 강한 조영증강을 보이는 경우가 더 많았고(P=0.002), 췌장 주위조직 침범은 더 적었으며(P=0.009) 종양의 크기가 더 작은 것으로(P=0.010) 나타났다. 병리학적 소견에서는 T병기(P<0.001), 림프절 전이(P<0.001), 현미경적 주위 신경조직 침범(P<0.001), 현미경적 림프관 또는 미세혈관침윤(P<0.001), 간 전이(P=0.001)가 G1에 비해 G2 및 G3에서 유의하게 많은 것으로 확인되었다(Table 4). 다변량분석 결과, 수술 전 영상검사에서 종양이 동맥기에서 강한 조영 증강을 보이는 경우(odds ratio [OR], 0.298; 95% confidence interval [CI], 0.091–0.969; P=0.044) G2 또는 G3 위험도가 낮았고, 수술 후 병리 소견에서 현미경적 림프관 또는 미세혈관침윤(OR, 5.119; 95% CI, 1.642–15.956; P=0.005)이 있을 때 G2 또는 G3 위험도가 높은 것으로 나타났다.
AJCC 7판 병기에 따라 1기와 2기 환자군을 비교 분석하였을 때, 수술 전 영상 소견에서는 1기에 비해 2기에서 췌관 확장(P=0.011) 및 췌장 주위 조직 침범(P=0.005) 소견이 많았고, 동맥기의 강한 조영증강(P<0.001) 소견은 적게 나타났다. 종양의 크기는 2기에서 유의하게 큰 것으로 확인되었고(P=0.009), 병리학적 소견에서는 1기에 비해 2기에서 현미경적 주위 신경조직 침범(P<0.001), 현미경적 림프관 또는 미세혈관침윤(P=0.004)이 유의하게 많았다(Table 5). 다변량 분석 결과, 수술 전 영상검사에서 동맥기 종양의 강한 조영증강 소견이 보이는 경우(OR, 0.130; 95% CI, 0.028.0.592; P=0.008) 낮은 AJCC 병기와 연관이 있었고, 수술 후 병리검사 결과 현미경적 주위 신경조직 침범(OR, 10.151; 95% CI, 1.582.65.147, P=0.015)이 높은 AJCC 병기와 관련 있었다.
재발한 군과 재발하지 않은 군을 비교하였을 때, 재발한 군에서 종양의 크기가 더 크고(P=0.001), T병기(P<0.001), 림프절 전이(P=0.003), 현미경적 주위 신경조직 침범(P<0.001), 현미경적 림프관 또는 미세혈관침윤(P=0.039)이 더 많았고 WHO 등급(P< 0.001) 및 AJCC 7판 병기(P<0.001)도 재발한 군이 병기가 더 높았다(Table6). 다변량 분석 시 현미경적 주위 신경조직 침범(OR, 4.399; 95% CI,1.218–15.879; P=0.024)이 재발 위험인자로 나타났고, 종양의 크기가 2 cm 보다 클 때(OR, 3.421; 95% CI, 0.951–12.312; P=0.060) 재발위험성이 높은 경향을 보였다. WHO 등급별 재발률은 G1에서 12.0%, G2에서 38.7%, G3는 60%였고, AJCC 7판 병기에 따른 재발률은 1기에서 11.0%, 2기에서 51.9%였다.
고 찰췌장의 신경내분비 종양은 매우 드문 질환으로서 전체 췌장의 종양 중 2% 미만을 차지하며[22], 임상적으로 두 그룹으로 분류되는데, 신경내분비 호르몬의 생성과 이와 관련된 특징적인 임상증상의 발현유무에 따라 기능성과 비기능성 신경내분비 종양으로 나뉜다. 이전 연구에서는 췌장 신경내분비 종양에서 비기능성 종양이 차지하는 비율이 15%.67%로 다양하게 보고되고 있으며[12], 본 연구진은 비기능성 종양 53예에 대해 보고한 적이 있으며[20] 이번 연구에서는 기능성 종양이 25예(21.6%), 비기능성 종양이 91예(78.4%)로 이전 보고에 비해 비기능성 종양의 비율이 다소 높게 나타났다. 인슐린종은 췌장 신경내분비 종양 중 가장 흔한 기능성 종양으로 알려져 있으며[23] Whipple’s triad로 특징되는 고인슐린혈증에 따른 저혈당에 의한 신경계 및 교감 신경계 증상이 관찰되고 가스트린종은 위궤양에 의한 증상, 위산과다 등에 의한 설사 및 체중 감소 등이 관찰된다. 소마토스타틴종은 대부분 무증상이며 담낭결석으로 검사 중 우연히 발견되는 경우가 많고, 고혈당증을 나타내는 경우도 있다[17]. 본 연구에서는 기능성 종양 25예 중 인슐린종이 16예(64%)로 가장 많았고 소마토스타틴종은 3예(12%), 글루카곤종이 1예(4%) 있었다. 인슐린종은 저혈당에 의한 의식소실, 어지러움증이 나타났고, 소마토스타틴종에서는 체중 감소와 비특이적인 상복부 통증이 관찰되었으며 글루카곤종은 체중 감소가 확인되었다. 비기능성 종양 91예중에서는 52예(57.1%)가 무증상으로 가장 많았고 비특이적인 상복부 복통이 22예(24.2%) 확인되었다. 기능성 신경내분비 종양은 호르몬에 의한 임상증상이 특이적이기 때문에 상대적으로 일찍 진단이 가능할 것으로 생각되나 이전 연구들에서는 진단 당시 연령에 있어서 통계학적으로 유의한 차이가 없는 것으로 보고되었다[5,24]. 그러나 본 연구에서는 기능성 신경내분비 종양의 진단 당시 연령이 유의하게 낮았다(P=0.008).
비기능성 종양의 생물학적 특성은 기능성 종양에 비해 더 침습적인 것으로 알려져 있다[7]. 췌장의 비기능성 내분비 종양은 악성 빈도가 높고 진단 시 이미 원격 전이가 있는 경우가 많으며, 특히 간 전이가 가장 흔한 것으로 알려져 있다[25]. 본 연구에서 수술 전 시행한 영상검사에서 췌관 확장, 담관 확장, 중심부 괴사, 췌장 주위 조직 침범 유무를 확인하였으나, 이러한 영상학적 특징은 기능성 종양과 비기능성 종양 간에 유의한 차이가 없었다. 기능성 종양은 비기능성 종양과 비교하여 병리학적 소견에서 림프절 전이, 현미경적 주위 신경조직 침범, 현미경적 림프관 또는 미세혈관침윤, 간 전이에서 유의한 차이가 없었다. 그러나 기능성 종양은 비기능성 종양에 비해 낮은 T병기(P=0.001), AJCC 7판 병기(P=0.001) 및 WHO 분류(P=0.015)를 보여 기능성 종양에 비해 비기능성 종양이 보다 진행된 병기에서 발견되었음을 알 수 있었다. 이러한 관찰 결과는 기능성 종양이 비기능성 종양에 비해 일찍 발견되었기 때문일 가능성과, 비기능성 종양이 기능성 종양에 비해 악성도가 높을 가능성을 모두 시사한다. 기존 연구에서도 비기능성 종양에서 원격 전이가 동반된 경우가 많아 질환의 악성도가 높았으며[7,26] 진단 시기에 있어서도 기능성 종양에 비해 늦게 발견되는 것으로 보고되었다[5,27].
췌장 신경내분비 종양의 병기 분류는 크게 AJCC 7판 분류 및 WHO 분류로 나뉘어진다. AJCC 7판 병기는 6판까지 별도의 분류가 없었던 췌장 신경내분비 종양에 췌장암의 분류방법을 적용하였다. 이러한 한계점에도 불구하고 Bilimoria 등[28]의 연구에 따르면 췌장
신경내분비 종양에서도 병기별 예후에 유의한 차이가 있는 것으로 보고되었다. 본 연구에서도 AJCC 7판 병기에 따라 1기와 2기 환자군을 비교 분석하였을 때, 1기에 비해 2기에서 현미경적 주위 신경조직 침범(P<0.001), 현미경적 림프관 또는 미세혈관침윤(P=0.004)이 유의하게 차이가 있는 것으로 나타나, AJCC 병기가 종양의 진행 정도와 연관성이 있음을 확인할 수 있었다. 본 연구진의 선행연구에서도 비기능성 종양에서 병리검사결과 AJCC 7판 병기(P=0.003)가 예후와 밀접한 상관관계를 보이는 것으로 나타났다[20].
2010년에 개정된 WHO 분류는 2005년 유럽 신경내분비 종양 학회에서 제시되었던 핵감수분열 및 Ki-67 지수를 반영하여 종양을 3개의 등급으로 나누었으나[16] 이전 분류 기준에 포함되어있던 종양의 크기가 제외되었고 그 임상적 가치는 아직 충분히 밝혀지지 않은 상태이다. 본 연구에서 WHO 분류에 따라 G1과 G2 및 G3으로 나누어 비교해 보았을 때, G1에서 T병기(P<0.001), 림프절 전이(P<0.001), 현미경적 주위 신경조직 침범(P<0.001), 현미경적 림프관 또는 미세혈관침윤(P<0.001), 간 전이(P=0.001)가 G2 및 G3 에 비해 유의하게 낮아 WHO 분류가 췌장 신경내분비 종양의 병리학적 특성과 밀접한 관련이 있음을 알 수 있었다. 2000년도에 제정된 이전 분류체계로 분석하였던 본 연구진의 선행연구에서도 비기능성 종양의 병리검사결과 WHO 분류(P<0.001)가 예후와 밀접한 상관관계를 보이는 것으로 나타났다[20]. 기존 연구에서 종양의 크기와 악성 여부와의 상관관계에 대해서는 아직 결론이 나지 않은 상태인데[27,29] 본 연구에서는 G1에서 종양의 크기가 유의하게 작은 것으로 나타나(P=0.010), 종양의 크기가 악성도와 연관성이 있음을 확인할 수 있었다. 그리고 WHO 등급이 AJCC 7판 병기와 비교하였을 때, 종양의 진행 정도에 따른 분류가 잘 이루어짐을 알 수 있었다.
췌장의 신경내분비 종양의 표준 치료는 수술로 알려져 있다[6]. 수술적 치료 후 장기간의 추적 결과도 5년 생존율이 50% 이상으로 보고 되고 있는데[30] 본 연구 결과에서 전체 환자의 5년 생존율은 96.7%로 기존 보고에 비해서 높은 편이었다. 기능성 종양의 5년 생존율은 100%, 비기능성 종양의 5년 생존율은 96.0%로 두 군 간의 유의한 차이는 없는 것으로 나타났다(P=0.579,). 본 연구진의 선행연구에서 비기능성 종양의 5년 생존율은 85.1%로 본 연구 결과에 비해서 낮았는데[20] 이는 최근 들어 신경내분비 종양이 보다 조기에 발견되어 치료성적이 높아진 것으로 해석된다. AJCC 7판 병기별 5년 생존율은 1기 98.6%, 2기 93.3%, 4기 66.7%였고(P=0.017), WHO 분류에 따른 5년 생존율은 G1 98.7%, G2 94.4%로(P=0.001) 조직학적 악성도가 증가함에 따라 예후가 불량하였다. 그러나 본 연구 대상환자 중 AJCC 7판에 따른 병 결과 수술 전 영상검사에서 종양이 동맥기에서 강한 조영 증강을 보이는 경우 낮은 병기와 관련이 있었고 수술 후 병리 소견에서 현미경적 림프관 또는 미세혈관 침윤이나 현미경적 주위 신경조직 침범이 있을 때 높은 병기와 연관성이 큰 것으로 나타났다. 현미경적 주위 신경조직 침범이 재발 위험인자로 나타났고, 통계적으로 유의하진 않았으나 종양의 크기가 2 cm 보다 클 때 재발 위험성과 관련이 있을 것으로 보았다.
췌장의 신경내분비 종양 중 특징적인 임상 증상이 동반될 경우 기능성 신경내분비 종양의 가능성을 의심해보는 것이 중요하다. 비기능성 종양은 진단 당시 연령이 높고, 진행된 종양일 경우가 상대적으로 많지만 수술적 치료로 비교적 양호한 예후를 기대할 수 있으므로 적극적인 치료 전략이 필요하다. 다변량 분석 결과 수술 전 영상검사에서 종양이 동맥기에서 강한 조영 증강을 보이는 경우 악성도는 낮으며, 수술 후 병리 소견에서 현미경적 림프관 또는 미세혈관침윤이나 현미경적 주위 신경조직 침범은 악성도와 연관성이 크다.
ACKNOWLEDGMENTSThis study was conducted under the Ministry of Health and Welfare National Cancer Control Planning funding.
REFERENCES1. Fischer L, Bergmann F, Schimmack S, Hinz U, Priess S, Muller-Stich BP, et al. Outcome of surgery for pancreatic neuroendocrine neoplasms. Br J Surg 2014;101:1405-12.
2. Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008;26:3063-72.
3. Halfdanarson TR, Rabe KG, Rubin J, Petersen GM. Pancreatic neuroendocrine tumors (PNETs): incidence, prognosis and recent trend toward improved survival. Ann Oncol 2008;19:1727-33.
4. Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, et al. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenterol 2010;45:234-43.
5. Kang TW, Lee KT, Ryu MK, Moon W, Lee SS, Lee SY, et al. Clinical features of neuroendocrine tumor of the pancreas: single center study. Korean J Gastroenterol 2006;48:112-8.
6. Gomez-Rivera F, Stewart AE, Arnoletti JP, Vickers S, Bland KI, Heslin MJ. Surgical treatment of pancreatic endocrine neoplasms. Am J Surg 2007;193:460-5.
7. Kim BK, Kang CM, Kim JY, Kim KS, Choi JS, Lee WJ, et al. Surgical experiences of neuroendocrine neoplasms of the pancreas: comparative study of functioning vs. non-functioning neoplasms. Korean J of HBP Surg 2007;11:1-6.
8. Turaga KK, Kvols LK. Recent progress in the understanding, diagnosis, and treatment of gastroenteropancreatic neuroendocrine tumors. CA Cancer J Clin 2011;61:113-32.
9. Ectors N. Pancreatic endocrine tumors: diagnostic pitfalls. Hepatogastroenterology 1999;46:679-90.
10. Broughan TA, Leslie JD, Soto JM, Hermann RE. Pancreatic islet cell tumors. Surgery 1986;99:671-8.
12. Madura JA, Cummings OW, Wiebke EA, Broadie TA, Goulet RL Jr, Howard TJ. Nonfunctioning islet cell tumors of the pancreas: a difficult diagnosis but one worth the effort. Am Surg 1997;63:573-7.
13. White TJ, Edney JA, Thompson JS, Karrer FW, Moor BJ. Is there a prognostic difference between functional and nonfunctional islet cell tumors? Am J Surg 1994;168:627-9.
14. Lo CY, van Heerden JA, Thompson GB, Grant CS, Soreide JA, Harmsen WS. Islet cell carcinoma of the pancreas. World J Surg 1996;20:878-83.
15. Chu QD, Hill HC, Douglass HO Jr, Driscoll D, Smith JL, Nava HR, et al. Predictive factors associated with long-term survival in patients with neuroendocrine tumors of the pancreas. Ann Surg Oncol 2002;9:855-62.
16. Rindi G, Kloppel G, Alhman H, Caplin M, Couvelard A, de Herder WW, et al. TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch 2006;449:395-401.
17. Sabiston DC, Townsend CM. Sabiston textbook of surgery the biological basis of modern surgical practice. Philadelphia: Elsevier/Saunders; 2012.
18. American Joint Committee on Cancer; American Cancer Society; American College of Surgeons. AJCC cancer staging manual. 7th ed. New York: Springer; 2010.
19. Bosman FT; World Health Organization; International Agency for Research on Cancer. WHO classification of tumours of the digestive system. Lyon: International Agency for Research on Cancer; 2010.
20. Park SM, Jang JY, Kang MJ, Yoon YS, Han HS, Cho JY, et al. Clinicopathologic characteristics and prognostic factors of nonfunctioning endocrine tumor of the pancreas. Korean J Hepatobiliary Pancreat Surg 2011;15:50-7.
21. Park JS, Lee DH, Jeong S, Cho SG. Determination of diameter and angulation of the normal common bileduct using multidetector computed tomography. Gut Liver 2009;3:306-10.
22. Vortmeyer AO, Huang S, Lubensky I, Zhuang Z. Non-islet origin of pancreatic islet cell tumors. J Clin Endocrinol Metab 2004;89:1934-8.
23. Okabayashi T, Shima Y, Sumiyoshi T, Kozuki A, Ito S, Ogawa Y, et al. Diagnosis and management of insulinoma. World J Gastroenterol 2013;19:829-37.
24. Lee YH, Sohn JH, Yun HJ, Kwon HJ, Chun JM, Kim SM, et al. Clinical features and long term survival of pancreatic neuroendocrine tumors according to the WHO classification. Korean J Hepatobiliary Pancreat Surg 2010;14:199-206.
25. Azimuddin K, Chamberlain RS. The surgical management of pancreatic neuroendocrine tumors. Surg Clin North Am 2001;81:511-25.
26. Han JH, Kim MH, Moon SH, Park SJ, Park do H, Lee SS, et al. Clinical characteristics and malignant predictive factors of pancreatic neuroendocrine tumors. Korean J Gastroenterol 2009;53:98-105.
27. Paik WH, Yoon YB, Lee SH, Park JK, Woo SM, Yang KY, et al. Pancreatic endocrine tumors: clinical manifestations and predictive factors associated with survival. Korean J Gastroenterol 2008;52:171-8.
28. Bilimoria KY, Bentrem DJ, Merkow RP, Tomlinson JS, Stewart AK, Ko CY, et al. Application of the pancreatic adenocarcinoma staging system to pancreatic neuroendocrine tumors. J Am Coll Surg 2007;205:558-63.
Figure 1.Clinical course of pancreas endocrine tumor. NED, no evidence of disease; r/o, rule out; LN, lymph node; RN, resection margin status-R0, R1, R2; d/t, due to; pul, pulmonary. 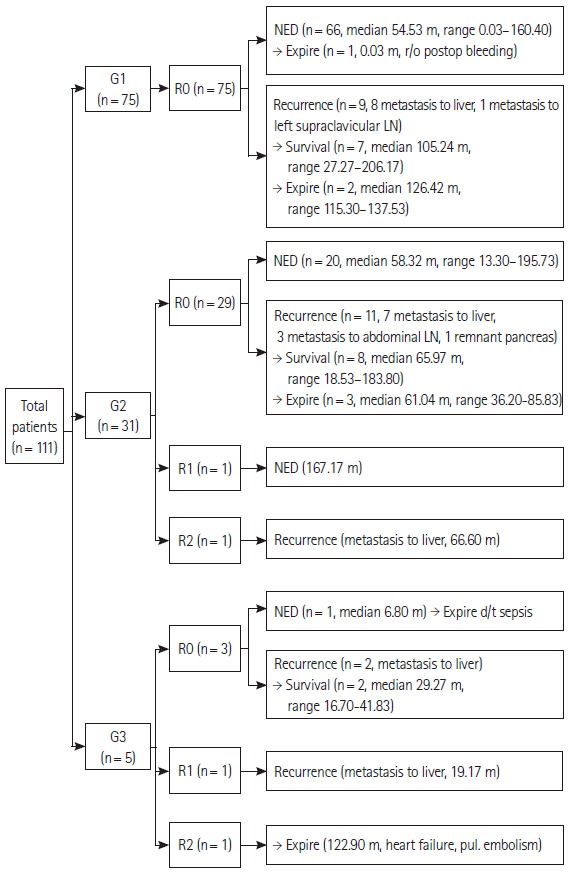
Figure 2.(A) Overall survival rate. (B) Overall survival according to functional status. YSR, year survival rate. 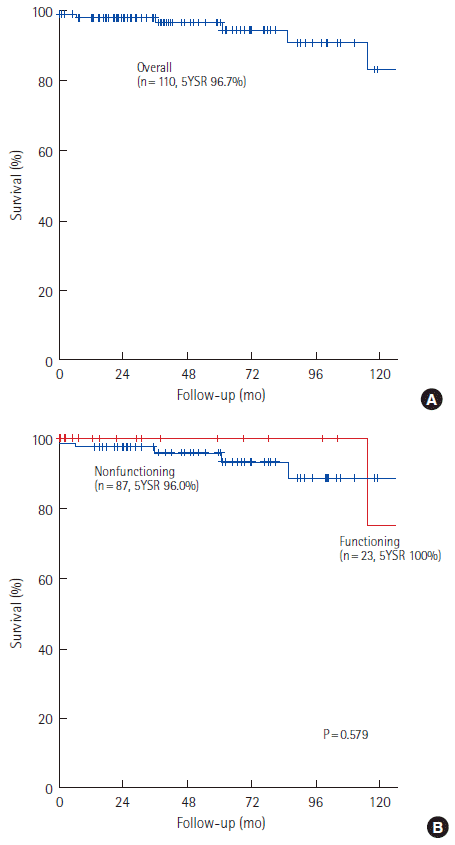
Figure 3.(A). Overall survival according to AJCC 7th stage. (B) Overall survival according to WHO (2010) grade. YSR, year survival rate; WHO, World Health Organization; AJCC, American Joint Committee on Cancer. 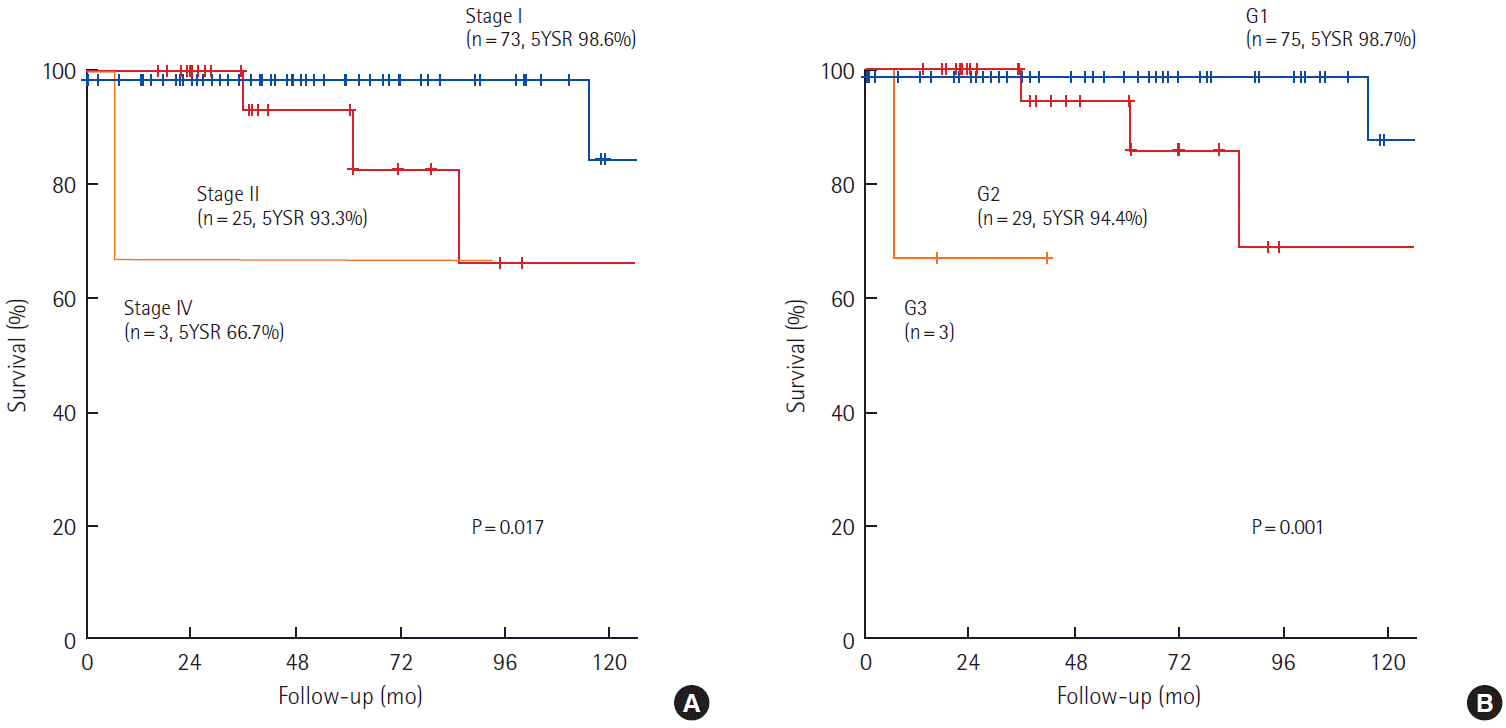
Table 1.Patient demographics Table 2.Pathology results Table 3.Clinical characteristics of recurrence cases WHO, World Health Organization; AJCC, American Joint Committee on Cancer; LN, lymph node; PD, pancreatoduodenectomy; N, no; Y, yes; RFA, radiofrequency ablation; TACE, transarterial chemoembolization; Op, operation; F/u, follow up; CTx, chemotherapy; EP, etoposide and cisplatin; IP, irinotecan and cisplatin; CAV, cyclophosphamide, adriamycin and vincristine. Table 4.Pathologic characteristics according to WHO classification Table 5.Pathologic characteristics according to AJCC stage Table 6.Pathologic characteristics associated with recurrence among patients who did not have distant metastasis at time of diagnosis |
|
|||||||||||||||||||||||||||||||||||||